Менингококковая инфекция у детей
Версия: Клинические рекомендации РФ 2023 (Россия)
Категории МКБ:
Менингококковая инфекция (A39), Носительство возбудителей других уточненных бактериальных болезней (Z22.3)
Разделы медицины:
Инфекционные болезни у детей, Педиатрия
Общая информация
Краткое описание
Разработчик клинической рекомендации
- Международная общественная организация «Евро-Азиатское общество поинфекционным болезням»
- Межрегиональная общественная организация «Ассоциация врачей-инфекционистов Санкт-Петербурга и Ленинградской области»
Одобрено Научно-практическим Советом Минздрава РФ
В соответствии с Правилами поэтапного перехода медицинских организаций к оказанию медицинской помощи на основе клинических рекомендаций, разработанных и утвержденных в соответствии с частями 3, 4, 6 –9 и 11 статьи 37 Федерального закона «Об основах охраны здоровья граждан в Российской Федерации», утвержденных постановлением Правительства Российской Федерации от 19.11.2021 № 1968, клинические рекомендации применяются следующим образом:
– размещенные в Рубрикаторе после 1 июня 2022 года – с 1 января 2024 года.
Клинические рекомендации
Менингококковая инфекция у детей
Год утверждения (частота пересмотра): 2023
Возрастная категория: Дети
Пересмотр не позднее: 2025
Дата размещения: 03.03.2023
ID: 58
Определение заболевания или состояния (группы заболеваний или состояний)
Менингококковая инфекция – антропонозное заболевание, передающееся воздушно-капельным путем и протекающее в виде бактерионосительства, назофарингита, менингококкемии и гнойного менингита, реже — с поражением других органов и систем [1].
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статической класификации болезней и проблем, связанных со здоровьем
По МКБ-10 МИ входит в рубрику «Некоторые инфекционные и паразитарные болезни», класс А; носительство менингококка — в рубрику «Факторы, влияющие на состояние здоровья населения и обращения в учреждения здравоохранения», класс Z:
А39.0 – Менингококковый менингит (G01);
А39.1–Синдром Уотерхауза-Фридериксена (менингококковый геморрагический адреналит, менингококковый адреналовый синдром) (E35.1);
А39.2 – Острая менингококкемия;
А39.3 – Хроническая менингококкемия;
А39.4 – Менингококкемия неуточненная (менингококковая бактериемия);
А39.5 – Менингококковая болезнь сердца (менингококковый кардит – У52.0), эндокардит (У39.0), миокардит (У41.0), перикардит (У32.0);
А39.8 – Другие менингококковые инфекции (менингококковый артрит (М01.0), конъюнктивит (Н13.1), энцефалит (G05/0), неврит зрительного нерва (Н48.1), постменингококковый артрит (М03.0);
А39.9 – Менингококковая инфекция неуточненная (менингококковая болезнь);
Z22.3 – Носительство возбудителей менингококковой инфекции.
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 500 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Менингококковая инфекция представлена разнообразными клиническими формами – от локализованных (назофарингита и менингококконосительства) до генерализованных, при молниеносном течении которых летальный исход может наступить через несколько часов от появления первых симптомов. [1,2,4,16,20,21,22, 23].
Клиническая классификация менингококковой инфекции.
В Российской Федерации в настоящее время принята классификация менингококковой инфекции В.И.Покровского, по которой выделяются локализованные, генерализованные и редкие формы инфекции [1].
1. Локализованные формы:
а) менингококконосительство;
б) острый назофарингит.
2. Генерализованные формы:
а) менингококкемия: типичная, молниеносная, хроническая;
б) менингит;
в) менингоэнцефалит;
г) смешанная (менингит и менингококкемия).
а) менингококковый эндокардит;
б) менингококковый артрит (синовит), полиартрит;
в) менингококковая пневмония;
г) менингококковый иридоциклит.
В большинстве зарубежных стран детальные клинические классификации МИ не используются; выделяют неинвазивные формы, соответствующие по классификации В.И.Покровского локализованным и инвазивные, соответствующие, генерализованным.
Этиология и патогенез
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Этиология. Возбудители менингококковой инфекции (МИ) — менингококки (Neisseria meningitidis), грамотрицательные бактерии, относятся к диплококкам, принадлежат семейству Neisseriaceae, роду Neisseria и являются строгими аэробами. В соответствии с особенностями строения полисахаридной капсулы менингококки подразделяют на серогруппы: A, B, C, X, Y, Z, W-135, 29-Е, K, H, L, I. Шесть серогрупп являются патогенными для человека : A, B, C, W, Y, X.[1,2,3,4]
Патогенез. Входные ворота для менингококка – слизистые оболочки носо- и ротоглотки.
Менингококк попадает на слизистую носоглотки капельным путем (назофарингеальная стадия), где происходит его размножение. Благодаря наличию местного гуморального иммунитета происходит быстрая гибель возбудителя без развития каких-либо клинических проявлений; в ряде случаев менингококк может вегетировать, не причиняя вреда хозяину, формируя менингококконосительство.
В 10-15% случаев при снижении резистентности организма, дефиците секреторного IgА внедрение менингококка приводит к воспалению слизистой оболочки носоглотки, вызывая развитие менингококкового назофарингита.
Группы риска по развитию генерализованных форм менингококковой инфекции (ГМИ) составляют дети раннего возраста, подростки, призывники, лица проживающие в условиях скученности (общежития, кампусы и т.п.), имеющие иммунодефицитные состояния (первичные и вторичные), лица, перенесшие кохлеарную имплантацию, открытую черепно-мозговую травму, имеющие ликворею.
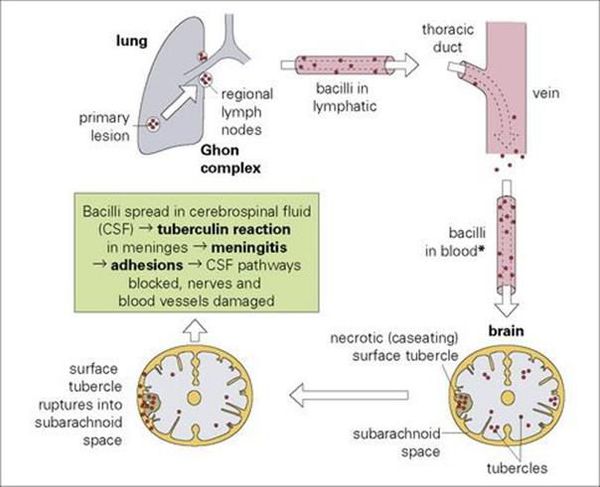
Менингококк может преодолевать гематоэнцефалический барьер и вызывать поражение мозговых оболочек и вещества мозга с развитием клинической картины гнойного менингита или менингоэнцефалита. Не исключается возможность проникновения возбудителя в оболочки мозга через решетчатую кость по лимфатическим путям и периневрально, однако это происходит в случае дефекта костей черепа или при черепно-мозговой травме.
Генерализация процесса сопровождается, наряду с бактериемией, выраженной эндотоксинемией. Ведущую роль в патогенезе тяжелых форм менингококковой инфекции играет системная воспалительная реакция (ССВР) организма, развивающаяся в ответ на бактериемию и токсинемию. В результате возникают гемодинамические нарушения, вплоть до развития септического шока, диссеминированного внутрисосудистого свертывания крови и глубоких метаболических расстройств, приводящих к тяжелому, нередко необратимому, поражению жизненно важных органов. Воспаление в мозговых оболочках, при преодолении менингококком гематоэнцефалического барьера, эндотоксенемия, гемодинамические и метаболические нарушения приводят к росту внутричерепного давления, возникновению отека головного мозга, при нарастании которого, возможно развитие дислокации церебральных структур с летальным исходом при сдавлении жизненно важных центров [2,5,6,7,8,9,10,11,12].
Эпидемиология
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Заболеваемость МИ в Российской Федерации имеет многолетнюю тенденцию к снижению, однако с 2016 отмечался подъем как общей заболеваемости (0,75 на 100 тыс. населения), так и ГМИ (1,81 на 100 тысяч детей до 14 лет) к концу 2019 года. Резкое снижение заболеваемости отмечалось в 2020-2021 г (.0,22 на 100 тыс. населения), что было связано с противоэпидемическими мероприятиями, направленными на борьбу с новой коронавирусной инфекцией. При рекордно низких показателях в 2021 году, в отдельных регионах уровни заболеваемости МИ превышают среднероссийский в 2–9 раз ( г. Москва (1,14 на 100 тыс. населения), Чукотский АО (2,0), Брянская (0,84), Астраханская (0,7), Пензенская (0,62), Новгородская области (0,5)) [13]
Доминирование той или иной серогруппы N.meningitidis разнится в различных регионах Российской Федерации. [3,14,15,16,17,18,19]. Согласно данным, представленным в Государственном докладе «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2021 году» серогрупповая характеристика инвазивных штаммов представлена в 27% Neisseria meningitidis серогруппы А, в 19% штаммами — С, в 13% – В (13 %), в 7% — W, в единичных случаях — Y. У детей до 5 лет чаще выделяли серогруппу С, у лиц 20–24 лет – серогруппу А. В 33 % этиологически подтвержденных случаев ГМИ серогрупповую характеристику определить не удалось [ 13].
Источник заболевания:
- менингококконосители,
- больные назофарингитом
- воздушно-капельный, контактно-бытовой.
Входные ворота: слизистая верхних дыхательных путей.
Инкубационный период составляет 2-10 дней (чаще 2-3 дня).
Структура заболеваемости:
- Менингококконосительство – 40%-43%, во время эпидемий – 70%-100%.
- Менингококковый назофарингит – 3%-5%.
- Менингококцемия – 36%-43%.
- Менингит – 10%-25%.
- Смешанная форма – 47%-55%.
МИ присуща определенная сезонность с пиком в зимне-весенний период (как правило, совпадает с эпидемическим подъемом ОРВИ, гриппа) и периодичность между отдельными подъемами эпидемической заболеваемости с интервалом в 28-30 лет [1,2,5,16,18].
Клиническая картина
Cимптомы, течение
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клиническая картина назофарингита не специфична, точный диагноз устанавливается только при наличии бактериологического подтверждения (Приложение А3.2).
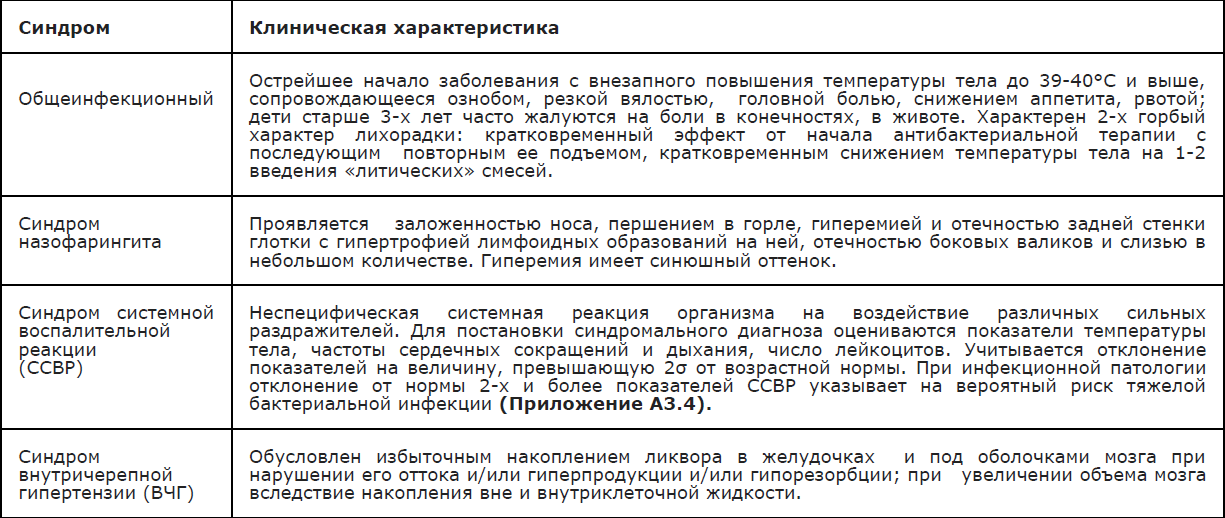
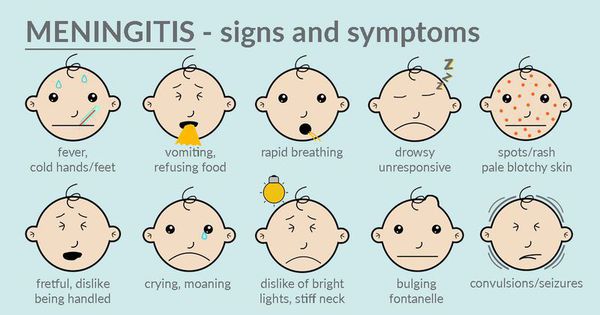
Клиническая картина ГМИ определяется ведущим патологическим синдромом; в «классическом» варианте» характерно острейшее начало с внезапно возникающей вялости на фоне подъема температуры тела до фебрильных цифр. До появления характерной для ГМИ (менингококкемия, смешанные формы) геморрагической звездчатой сыпи заподозрить менингококковую природу заболевания (вне очага МИ) практически невозможно. Основные синдромы, встречающиеся при различных формах ГМИ у детей представлены в Приложении А3.2.
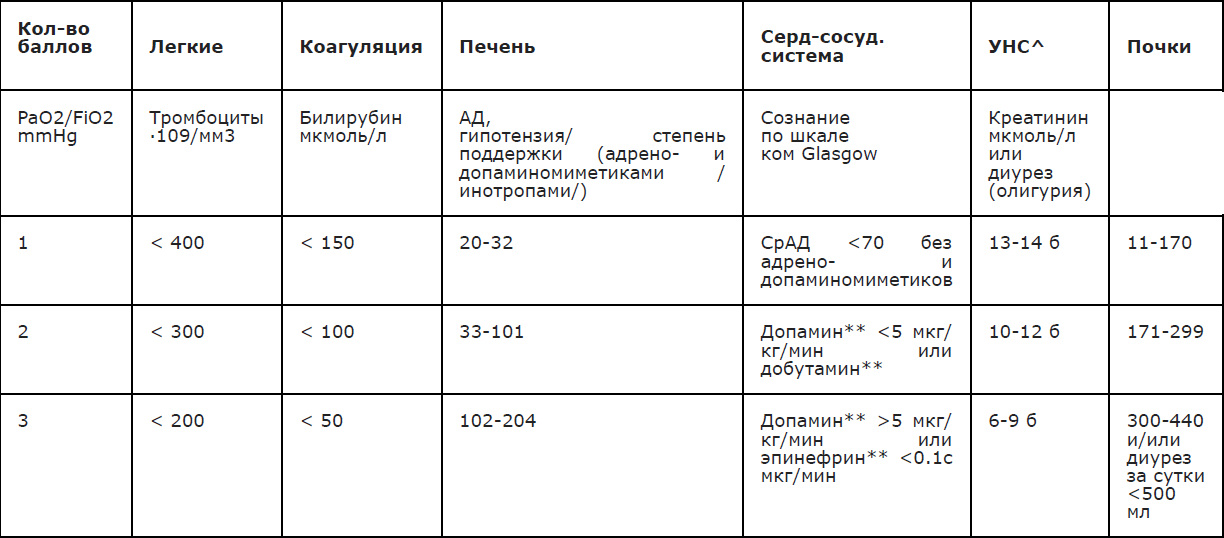
Тяжесть ГМИ определяется высокой частотой развития жизнеугрожающих осложнений, таких как септический шок, синдром диссеминированного внутрисосудистого свертывания, острая почечная недостаточность, отек головного мозга (Приложение А 3.3) [1,3,21,22,23,24,25,26,27,28]
Комментарии: Лихорадка при ГМИ может иметь 2-х волновый характер. После первого подъема температуры, который удается сбить препаратами группы «анилиды» (N02BE- (парацетамол**) и/или нестероидными противовоспалительными и противоревматическими препаратами (производные пропионовой кислоты (ибупрофен**) наблюдается период относительного благополучия, который может продолжаться до нескольких часов. Через некоторый промежуток времени, который может составлять несколько часов, отмечается повторное повышение температуры тела, плохо снижающейся после приема ибупрофена** и/ либо парацетамола**).
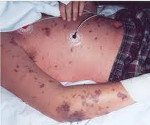
Термин «звездчатая», применяемый к сыпи при ГМИ, связан не столько с формой элементов, сколько с характером их распространения на теле: разбросаны как «звезды на небе»
Диагностика
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Общие подходы к диагностике.
Диагностика МИ производится путем сбора анамнеза, детального уточнения жалоб, клинического осмотра, дополнительных (лабораторных и инструментальных) методов обследования и направлена на определение клинической формы, тяжести состояния, выявления осложнений и показаний к лечению, а также на выявление в анамнезе факторов, которые препятствуют немедленному началу лечения или требующие коррекции лечения.
2.1 Жалобы и анамнез
МИ может протекать в различных формах с сочетанием тех или иных синдромов (Приложение А3.2). Угрозу представляют генерализованные формы, в связи с высоким риском развития жизнеугрожающих осложнений (Приложение А3.3 –А3.9).
-
Рекомендуется всем больным с подозрением на менингококковую инфекцию проводить сбор анамнеза и жалоб («Сбор анамнеза и жалоб при инфекционном заболевании») [4,13,29].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5).
Комментарий: Уточняются возможные контакты в семье, в ближнем окружении заболевшего, факты пребывания либо тесный контакт с лицами, посещавшими регионы с высоким уровнем заболеваемости МИ (страны «менингитного пояса» Субэкваториальной Африки; Саудовская Аравия).
-
Рекомендуется акцентировать внимание на жалобах, свидетельствующих о высоком риске развития ГМИ, к которым относится: сочетание острейшего начала заболевания с появлением стойкой фебрильной лихорадки в сочетании с геморрагической сыпью, мышечными, суставными, абдоминальными болями, головной болью, рвотой, снижением диуреза [1,4,24,25,26,30,31].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарий: Для ГМИ характерен резкий подъем температуры до высоких цифр (38,5-40оС и выше); часто отмечается двух-горбый характер температурный кривой – на первый подъем температуры отмечается кратковременный эффект на применяемые нестероидные противовоспалительные препараты (производными пропионовой кислоты (ибупрофен**) либо препараты группы «анилиды» (парацетамол**)), при повторном подъеме температуры (через 2-6 часов) введение средств с жаропонижающим действием (ибупрофен** либо парацетамол**) эффекта не оказывает. Подобный характер температурной кривой наблюдается не только при ГМИ, но и при других тяжелых инфекциях протекающих с синдромом сепсиса, при вирусных и бактериальных нейроинфекциях (энцефалит, менингит).
При наличии сыпи рекомендовано уточнять время появления первых элементов, их характер, локализацию, динамику изменений. Патогномоничным для ГМИ является наличие геморрагической сыпи, однако, в большинстве случаев, появлению геморрагических элементов предшествует розеолезная или розеолезно-папулезная сыпь (т.н.rash-сыпь), элементы которой могут располагаться на различных участках тела и часто расцениваются как аллергические проявления. Появление распространенной геморрагической сыпи без предшествующей rash-сыпи через несколько часов от дебюта заболевания, как правило, свидетельствуют о крайней степени тяжести заболевания.
Жалобы на абдоминальные боли и боли в конечностях на фоне фебрильной лихорадки относятся к «красным флагам» генерализованных бактериальных инфекций, протекающих с синдромом сепсиса и являются характерными жалобами при ГМИ у детей школьного возраста и взрослых, зачастую являясь предвестниками развития септического шока (генез их связывают с нарастающей тканевой гипоперфузией и тробмозом сосудов различного калибра на фоне прогрессирования ДВС-синдрома).
Наличие головной боли и рвоты при ГМИ чаще наблюдается при наличии менингита, однако может выявляться и при отсутствии воспалительных изменений в ЦСЖ.
2.2 Физикальное обследование
- Рекомендуется всем детям и подросткам с подозрением на МИ проведение визуального исследования («Визуальное исследование при инфекционном заболевании») [4, 24,25,26]
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 5)
Комментарий: наличие ГМИ должно предполагаться при сочетании геморрагической сыпи, не исчезающей при надавливании, возникшей на фоне лихорадки. Наиболее типична геморрагическая сыпь в виде неправильной формы элементов, плотных на ощупь, выступающих над уровнем кожи. Количество элементов сыпи самое различное — от единичных, до покрывающих сплошь всю поверхность тела. Чаще всего сыпь локализуется на ягодицах, задней поверхности бедер и голеней; реже — на лице, веках и склерах, и обычно при тяжелых формах болезни. Розеолезные и розеолезно-папулезные элементы предшествующей rach-сыпи (наблюдающиеся в 50-80% случаев ГМИ) быстро исчезают, не оставляя никаких следов в течение 1-2 суток с момента появления
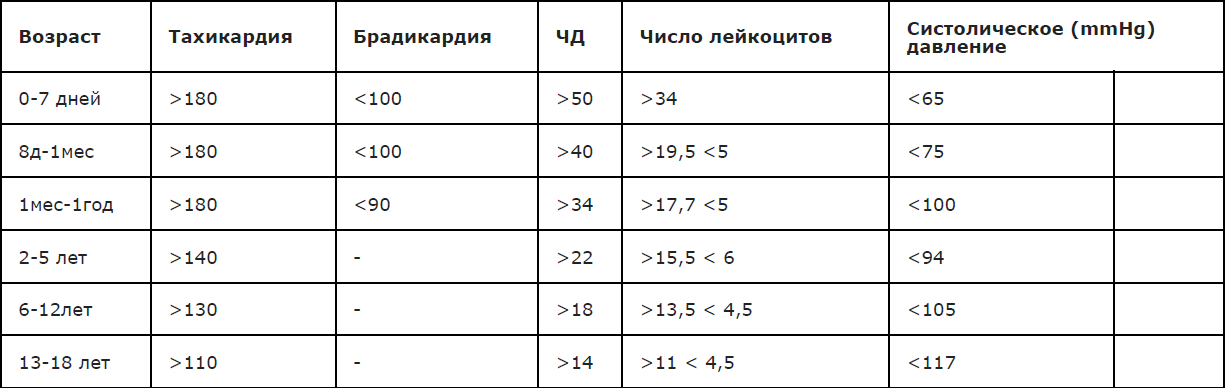
Сочетание лихорадки и геморрагической сыпи наблюдается не только при ГМИ; определенную помощь в оценке тяжести состояния пациента представляет наличие/отсутствие клинических признаков системной воспалительной реакции (ССВР) с определением частоты и качеством пульса, дыхания, уровня артериального давления, (Приложение А3.4 ). Выявление 2-х и более признаков ССВР ассоциировано с высоким риском наличия тяжелой бактериальной (в т.ч.менингококковой) инфекции. Пороговые диагностические значения ССВР в зависимости от возраста представлены в Приложении А3.5
-
Рекомендуется у детей и подростков с подозрением на ГМИ для оценки тяжести состояния оценивать: уровень сознания, температуру и окраску кожных покровов, время капиллярного наполнения, параметры артериального давления, частоту и характер дыхания, диурез, наличие менингеальных симптомов, очаговой неврологической симптоматики [4, 24,25,26,27,30].
Уровень убедительности рекомендаций C (уровень достоверности доказательств –5).
Комментарий: Степень нарушения сознания оценивается по шкале комы Глазго, где 15 баллов соответствует ясному сознанию, уровень 3 бала и менее – запредельной коме (Приложения Г3, Г4). В дебюте ГМИ может наблюдаться возбуждение, с последующим угнетением от сомноленции до глубокой комы.
Наличие патологических видов дыхания выявляется при крайней тяжести течения ГМИ в случаях развития дислокационного синдрома на фоне ОГМ либо в терминальной стадии заболевания, осложненного рефрактерным септическим шоком.
Признаками нарушения микроциркуляции является бледность, синюшность, мраморный рисунок кожных покровов, гипотермия дистальных отделов конечностей.
Для объективизации состояния гемодинамики целесообразно использовать шоковый индекс Альговера (норма: ЧСС/АД с= 0,54)
В первые часы от начала заболевания менингеальные симптомы могут быть отрицательные даже при смешанных формах и изолированном ММ, максимальная выраженность менингеальных симптомов отмечается на 2-3 сутки. Для младенцев характерна диссоциация менингеальных симптомов; для первого года жизни наиболее информативными симптомами являются – стойкое выбухание и усиленная пульсация большого родничка и ригидность затылочных мышц.
2.3 Лабораторные диагностические исследования
-
Рекомендуется всем больным с подозрением на ГМИ провести общий (клинический) анализ крови развернутый [4, 21,24,31,32].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5).
Комментарии: Является обязательным, но не специфичным для диагностики ГМИ исследованием: выявление в дифференцированном подсчете лейкоцитов (лейкоцитарная формула) лейкопении или лейкоцитоза, выходящих за возрастные референсные значения и сопровождающихся нейтрофильным сдвигом, указывает на высокую вероятность бактериальной природы заболевания. В случаях отсутствия бактериологического подтверждения ГМИ при наличии «типичной» клинической картины заболевания (острейшее начало, лихорадка, геморрагическая сыпь), воспалительные изменения в клиническом анализе крови могут быть одним из оснований для постановки клинического диагноза.
-
Рекомендуется всем больным с подозрением на ГМИ проведение развернутого биохимического обследования: анализ крови биохимический общетерапевтический [4, 21,24,26, 30,31,32, 33].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: Изменение биохимических показателей крови позволяет диагностировать органную дисфункцию, оценить степень поражения и эффективность проводимой терапии.
-
Рекомендуется всем больным с подозрением на ГМИ исследование кислотно-основного состояния и газов крови [4, 21,24,26, 30,31,32, 33].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: исследование необходимо для оценки дыхательной недостаточности, степени тканевой гипоперфузии
-
Рекомендуется всем пациентам с подозрением на ГМИ определение уровней С-реактивного белка и прокальцитонина в крови [4,24,25,30,34,35, 36].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Выявление в крови повышения С-реактивного белка >2 стандартных отклонений от нормы и прокальцитонина >2 нг/мл указывает на наличие бактериальной инфекции. В острый период ГМИ показатели СРБ и ПКТ, как правило в десятки раз превышают норму. Для оценки эффективности проводимой антибактериальной терапии большей специфичностью обладает ПКТ – нормализация его показателей может быть .основанием для окончания антибактериальной терапии. Повышенный уровень СРБ у некоторых пациентов может сохраняться и при нормализации показателей ПКТ, что может быть связано с местными воспалительными реакциями не бактериальной природы, с наличием системных аутоиммунных процессов.
-
Рекомендуется исследование показателей гемостаза всем пациентам с подозрением на ГМИ с определением длительности кровотечения, времени свертываемости крови, коагулограммы (ориентировочное исследование системы гемостаза) [4,24,25,26, 30, 31].
Уровень убедительности рекомендаций С (уровень достоверности доказательств –5)
Комментарии: Для диагностики ДВС-синдрома. Параметры гемостаза меняются соответственно стадиям ДВС-синдрома, исследование системы гемостаза необходимо для оценки эффективности проводимой терапии и ее коррекции.
-
Рекомендуется Микроскопическое исследование цереброспинальной жидкости, подсчет клеток в счетной камере (определение цитоза) и биохимическое исследование с определением уровня белка, глюкозы, натрия, хлоридов и лактата в спинномозговой жидкости всем пациентам с подозрением на смешанную форму ГМИ или ММ [1,4,20,24,32,36].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Проведение спинномозговой пункции (СП) возможно только при отсутствии противопоказаний (Приложение А3.10), при их наличии исследование проводится после стабилизации состояния больного. Учитывая отсутствие специфических менингеальных проявлений у детей раннего возраста, исследование ЦСЖ показано всем пациентам первого года жизни с ГМИ. Оцениваются качественные характеристики ЦСЖ — цвет, прозрачность и количественные — плеоцитоз с определением клеточного состава, уровни белка, глюкозы, натрия, хлоридов. Для ММ, как и других бактериальных менингитов, характерно наличие нейтрофильного плеоцитоза, повышение уровня белка, снижение уровня глюкозы. В первые часы заболевания и при проведении СП на поздних сроках, плеоцитоз может быть смешанным. При необходимости проведения дифференциальной диагностики между бактериальной и вирусной природой менингита целесообразно исследовать уровень лактата в ЦСЖ, повышение которого, характерно для БГМ, однако диагностическая ценность данного исследования резко снижается уже после первого введения антибиотика.
-
Рекомендуется всем пациентом с подозрением на ГМИ, вне зависимости от формы заболевания, микробиологическое (культуральное) исследование слизи с задней стенки глотки, со слизистой носа на менингококк (Neisseria meningitidis) [1,4,20,24,29,32].
Уровень убедительности рекомендаций C (уровень достоверности доказательств –5).
Комментарий: Микробиологическое (культуральное) исследование слизи с задней стенки глотки на менингококк (Neisseria meningitidis) позволяет верифицировать этиологический диагноз назофарингита и установить носительство N.meningitidis. Для генерализованных форм ГМИ, при отсутствии обнаружения N.meningitidis в стерильных жидкостях (кровь/ликвор/синовиальная жидкость), обнаружение менингококка на слизистых носоглотки не может являться основанием для точной верификации этиологического диагноза, однако является важным фактором для выбора АБТ, которая должна способствовать как лечению системного заболевания, так и эрадикации менингококка со слизистых носоглотки.
-
Рекомендуется всем больным с подозрением на ГМИ микробиологическое (культуральное) исследование крови на стерильность [1,4,20,24,29,32].
Уровень убедительности рекомендаций В (уровень достоверности доказательств –5).
Комментарии: Микробиологическое (культуральное) исследование крови и ЦСЖ на стерильность с выделением и идентификацией культуры менингококка служит «золотым стандартом» для этиологической верификации заболевания. Забор образцов крови должен осуществляться максимально быстро от момента поступления пациента в стационар, до начала АБТ. Исследование крови особенно важно в ситуациях, когда есть противопоказания к проведению спинномозговой пункции. Отсутствие роста возбудителя не исключает менингококковой этиологии заболевания, особенно в случаях, когда забору биологического материала предшествует введение АБТ
-
Рекомендуется всем больным с подозрением на смешанную форму ГМИ или ММ микробиологическое (культуральное) исследование (посев) цереброспинальной жидкости [4,20,24,29,33].
Уровень убедительности рекомендаций В (уровень достоверности доказательств –3).
Комментарии: Выделение из крови и ЦСЖ культуральным методом бактериальных возбудителей позволяет не только верифицировать этиологию заболевания, но и оценивать чувствительность патогена к антибактериальным препаратам.
-
Рекомендуется молекулярно-биологическое исследование крови на менингококк (Neisseria meningitidis) с определением ДНК менингококка (Neisseria meningitidis) в крови методом ПЦР [4,20,24,30, 32,33,36]
Уровень убедительности рекомендаций С (уровень достоверности доказательств –5).
Комментарии: Амплификация нуклеиновых кислот возбудителей бактериальных нейроинфекций осуществляется путем определения ДНК менингококка (Neisseria meningitidis) в условно стерильных жидкостях ( кровь. ЦСЖ) методом ПЦР. Выявление фрагментов ДНК менингококка методом ПЦР в стерильных жидкостях достаточно для установления этиологии заболевания.
-
Рекомендуется молекулярно-биологическое исследование спинномозговой жидкости на менингококк (Neisseria meningitidis) с определением ДНК менингококка (Neisseria meningitidis) и спинномозговой жидкости методом ПЦР [4,20,24,32,37-40]
Уровень убедительности рекомендаций А (уровень достоверности доказательств- 1)
Комментарий: Для проведения дифференциальной диагностики с другими гнойными бактериальными менингитами, а также серозными менингитами (вирусными, грибковыми) рекомендуется выполнение мультиплексного ПЦР тестирования ликвора в экспресс- режиме с возможностью одномоментной идентификации широкого спектра патогенов. Разработаны и доступны для использования панели для «синдромальной диагностики» внебольничных нейроинфекций методом мультиплексной ПЦР в экспресс режиме за 60 минут, которые предназначены для одновременной идентификации 14 возбудителей, наиболее часто вызывающих внебольничные менингиты и/ энцефалиты: Neisseria meningitidis, Streptococcus pneumoniae, Haemophilus influenzae, Listeria monocytogenes, Streptococcus agalactiae, Escherichia coli K1, Вирус простого герпеса 1-го и 2 типа, Вирус герпеса человека 6-го типа, Энтеровирус, Цитомегаловирус, Варицелла-Зостер вирус, Парэховирус человека и Cryptococcus neoformans/gattii. (Совокупная чувствительность — 94,2%, совокупная специфичность — 99,8%). Выявление фрагментов ДНК менингококка методом ПЦР в стерильных жидкостях достаточно для установления этиологии заболевания.
-
Рекомендуется проведение реакции агглютинации латекса (РАЛ) в ЦСЖ для определения антигенов N.meningitidis в качестве вспомогательного метода экспресс-диагностики ГМИ. [20,24,32,36].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5).
Комментарии: Используемые на практике тест-системы для РАЛ в диагностике бактериальных нейроинфекций позволяют выявлять антигены менингококков А, B,C,Y/W135, пневмококков, гемофильной палочки. Обнаружение АГ бактериальных возбудителей в ЦСЖ при наличии клинической картины ГМИ либо БГМ позволяет с большой долей вероятности верифицировать этиологию заболевания. Возможны ложно-положительные и ложно-отрицательные результаты, поэтому, помимо РАЛ необходимо учитывать результаты культуральных и молекулярных методов. В случаях расхождения данных РАЛ с результатами ПЦР либо посевов, для верификации этиологического диагноза предпочтение отдается последним.
-
Рекомендуется микроскопическое исследование спинномозговой жидкости на менингококк (Neisseria meningitidis) — исследование нативного мазка ЦСЖ, окрашенного по Граму, в качестве вспомогательного ориентировочного метода этиологической диагностики [20,24,32,36].
Уровень убедительности рекомендаций С (уровень достоверности доказательств –5)
Комментарии: Обнаружение характерных Грам-отрицательных диплококков в мазке служит ориентировочной оценкой и может быть основанием для начала специфической терапии, однако без дополнительных бактериологических исследований, только на основании микроскопии верификация МИ не проводится.
-
Рекомендуется считать достоверным диагнозом МИ случаи типичных клинических проявлений локализованной, либо генерализованной формы МИ в сочетании с выделением культуры менингококка при микробиологическом культуральном исследовании (бактериологическом посеве) стерильных жидкостей (крови, ликвора, синовиальной жидкости), либо при обнаружении ДНК (ПЦР) или антигена (РАЛ) менингококка в крови или ЦСЖ. [20,32,36].
Уровень убедительности рекомендаций C (уровень достоверности доказательств –5).
Комментарий: Высев менингококка в микробиологическом (культуральном) исследовании слизи с задней стенки глотки на менингококк (Neisseria meningitidis) учитывается для диагностики локализованных форм МИ (носительство, назофарингит), но не является основанием для этиологического подтверждения диагноза ГМИ при отрицательных результатах посевов, РАЛ , ПЦР ЦСЖ и крови.
-
Рекомендуется считать вероятным диагнозом ГМИ случаи заболевания с характерными для ГМИ клинико-лабораторными проявлениями при отрицательных результатах бактериологического обследования. [20,32,36,37].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: При отрицательных результатах этиологического обследования, диагноз менингококкемии или смешанной формы ГМИ может быть установлен клинически при наличии характерных клинико-лабораторных проявлений (острое/острейшее начало, проявления ССВР, геморрагическая сыпь, воспалительные изменения в гемограммах, повышение уровня СРБ и ПКТ> 2 нг/мл) [1,4,21,23,32,36].
-
Рекомендуется учитывать, что диагноз менингококкового менингита может быть установлен только по результатам исследования ЦСЖ [43].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарий: Достоверный диагноз менингококкового менингита правомочен только в случаях выявления плеоцитоза (нейтрофильного или смешанного, в зависимости от сроков проведения исследования) в сочетании с выделением культуры и/или ДНК или антигена менингококка в ЦСЖ или крови.
Невысокий плеоцитоз при наличии в ЦСЖ бактерий (высев, ПЦР), встречается у недоношенных детей и у пациентов с иммунодефицитными состояниями.
2.4 Инструментальные диагностические исследования
Методы инструментальной диагностики позволяют объективизировать тяжесть состояния больного с ГМИ, выявлять специфические и неспецифические осложнения.
-
Рекомендуется регистрация электрокардиограммы, расшифровка, описание и интерпретация электрокардиографических данных (ЭКГ) и эхокардиографии (Эхо-КГ) всем пациентам с ГМИ для выявления поражений сердца [1,4,11,26].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5).
Комментарии: Оценка параметров ЭКГ и ЭхоКГ позволяет выявить признаки поражения сердца (миокарда, проводящей системы), характерные для ГМИ. Кроме того, показатели сократительной способности миокарда и сердечного выброса учитываются при оценке степени выраженности СШ и используются для коррекции проводимой терапии.
-
Рекомендуется проведение рентгенограммы органов грудной клетки всем пациентам с ГМИ, с подозрением на пневмонию, пациентам ОРИТ, требующим обеспечения центрального сосудистого доступа, для контроля стояния центрального сосудистого катетера. [26,28,31,36,44, 54]
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5).
Комментарии: Используется при проведении дифференциальной диагностики с воспалительными заболеваниями легких (пневмония), а также для контроля постановки центрального сосудистого катетера.
-
Рекомендуется проведение ультразвукового исследования головного мозга всем детям с подозрением на БГМ [45-46].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 5).
Комментарии: Используется для оценки состояния церебральных структур, степени выраженности отека головного мозга (сужение ликворных пространств), признаков смещения срединных структур головного мозга, наличие косвенных признаков бактериального менингита, выявление интракраниальных осложнений бактериального менингита; наиболее информативно проведение у детей до 1 года при открытом большом родничке.
-
Рекомендуется проведение ультразвукового исследования органов брюшной полости, почек и надпочечников у пациентов с ГМИ [30,31, 47].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 4).
Комментарии: Используется для оценки состояния внутренних органов, наличия жидкости в брюшной полости, выявления кровоизлияний в надпочечники.
-
Рекомендуется проведение ультразвукового исследования головного мозга, ультразвуковой допплерографии транскраниальной артерий методом мониторирования пациентам со смешанными формами МИ и ММ, ультразвуковой допплерографии сосудов (артерий и вен) нижних конечностей при клинических признаках нарушений кровотока [30, 46,49,50] ,
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5).
Комментарии: Позволяет оценить нарушения церебрального кровотока на фоне отека головного мозга, оценить нарушения кровотока по периферическим сосудам вследствие падения АД при CШ и ДВС-синдроме.
-
Рекомендуется проведение ультразвукового исследования глазного яблока для оценки ширины зрительного нерва пациентам с ГМИ при подозрении на менингит [4, 45].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5).
Комментарий: Утолщение зрительного нерва с оболочками наблюдается при ВЧГ; при прогрессировании которой визуализируется нарастание толщины нерва и стушеванность его очертаний, что совпадает с офтальмологическими признаками ОГМ. Мониторинг толщины зрительного нерва в динамике заболевания позволяет оценивать эффективность терапии, направленной на нормализацию внутричерепного давления и купирование ОГМ.
-
Рекомендуется проведение офтальмоскопии при подозрении на БГМ перед проведением спинномозговой пункции. [51,52]
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 5).
Комментарии: Визуально-инструментальное исследование глазного дна при офтальмоскопии позволяет выявить косвенные признаки ВЧГ и ОГМ. Данные офтальмоскопии должны учитываться при определении показаний/ противопоказаний к проведению спинномозговой пункции. Отсутствие изменений на глазном дне не исключает наличия ОГМ: при стремительном его развитии клинические проявления опережают появление характерной офтальмоскопической картины отека.
-
Рекомендуется проведение электроэнцефалографии у пациентов с ГМИ, в случаях, сопровождающихся развитием ОГМ, судорог, энцефалопатии [4,36].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5).
Комментарии: По оценке выраженности нарушений биоэлектрической активности головного мозга можно косвенно оценить признаки отека головного мозга; локальные изменения биоэлектрической активности указывают на очаговые нарушения в головном мозге, что может быть связано с локальными интракраниальными осложнениями ГМИ (энцефалитом, инсультом); выявление паттернов эпилептиформной активности позволяет назначать/корректировать противосудорожную терапию.
-
Рекомендуется проведение исследования акустических стволовых вызванных потенциалов (АСВП) у пациентов с ММ для раннего выявления повреждения слуховых анализаторов [4,36].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5).
Комментарии: Исследование проводимости по структурам слухового анализатора позволяет выявить на ранних сроках повреждение слухового анализатора, которое может развиться на фоне ГМИ и ММ, а также оценить состояние стволовых структур головного мозга.
-
Рекомендуется проведение электронейромиограммы пациентам с ГМИ, длительно (более 5 суток) находившимся на ИВЛ для выявления признаков полинейропатии критических состояний, при отсутствии у них самостоятельного эффективного дыхания после стабилизации состояния по основному заболеванию, либо при наличии двигательных нарушений после отлучения от аппарата ИВЛ [53].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 4).
Комментарии: Риск развития полинейропатии критических состояний (ПНПКС) существует у всех больных с сепсисом/ длительно сохраняющимися проявлениями ССВР, находящимися на ИВЛ более 5-7 суток. Нарушения со стороны периферической нервной системы при ПНПКС могут быть причиной затруднений отлучения больного от аппарата ИВЛ.
-
Рекомендуется проведение компьютерной томографии или магнитно-резонансной томографии головного мозга больным с ГМИ при выявлении очаговой неврологической симптоматики, не наблюдавшейся до начала заболевания, в случаях затяжного течения менингита с отсутствием санации ЦСЖ на фоне эффективной in vitro антибактериальной терапии [4,45].
Уровень убедительности рекомендаций C (уровень достоверности доказательств -5).
Комментарии: КТ и МРТ относятся к экспертным методам визуализации, однако следует учитывать, что проведение данных исследований возможно только больным со стабильной гемодинамикой. При наличии очаговой неврологической симптоматики данные методы позволяют оценить состояние различных интракраниальных структур, выявить зоны поражения вещества мозга, оценить их размер и расположение, диагностировать наличие конкретного осложнения. Для исключения вторичной природы БГМ (посттравматической, при заболеваниях ЛОР-органов) методом выбора является КТ. Относительным преимуществом КТ является быстрота исследования, возможность проведения больным, находящимся на ИВЛ, без применения специальной немагнитной аппаратуры. МРТ позволяет проводить более детальную оценку состояния ткани мозга и церебральных сосудов, однако требует использования специальной аппаратуры и значительно продолжительнее по времени.
2.5 Иные диагностические исследования
Дифференциальная диагностика.
-
Рекомендуется при наличии экзантемы проводить дифференциальную диагностику ГМИ с заболеваниями, для которых характерно наличие геморрагической и пятнисто-папулезной сыпи (Приложение А3.11) [1,4,24,26].
Уровень убедительности рекомендаций C (уровень достоверности доказательств -5).
Комментарий: Проводится дифференциальный диагноз с инфекционными и неинфекционными заболеваниями, для которых характерно наличие геморрагической сыпи.
-
Рекомендуется при наличии плеоцитоза в ЦСЖ проводить дифференциальный диагноз с менингитами иной этиологии и неинфекционными заболеваниями, протекающими с изменением ЦСЖ [1,4,24,26] .
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарий: Проводится дифференциальный диагноз менингитами различной этиологии, неинфекционными заболеваниями, сопровождающимися наличием плеоцитоза.
Лечение
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
3.1 Консервативное лечение
Средства этиотропной терапии при лечении локализованных форм МИ (назофарингит, носительство менингококка).
-
Рекомендуется в качестве этиотропных препаратов при лечении локализованных форм МИ использование антибактериальных препаратов системного действия (J01) [4, 54, 55].
Уровень убедительности рекомендаций C (уровень достоверности доказательств–5)
Комментарии: при лечении локализованных форм МИ используют средне-терапевтические дозы антибиотиков, активных в отношении N.meningitidis, наиболее часто: антибиотики — пенициллины широкого спектра действия – ампициллин**, амоксициллин** (J01СА); комбинации пенициллинов, включая комбинации с ингибиторами беталактамаз (J01СR) в формах для приема внутрь. В большинстве случаев применяется ампициллин** (детям с массой тела до 20 кг — 12.5-25 мг/кг/сутки; более 20 кг – 250-500 мг каждые 6 часов.
Этиотропная терапия при лечении генерализованных форм МИ.
-
Рекомендуется при проведении этиотропной терапии ГМИ использовать только парентеральный путь введения препаратов [1,4,26,30,36,54].
Уровень убедительности рекомендаций C (уровень достоверности доказательств–5)
Комментарии: При ГМИ, протекающий без СШ, допустимо внутримышечное введение препаратов; при развитии СШ – только внутривенное (внутрикостное) введение, т.к. в условиях тканевой гипоперфузии внутримышечное введение препаратов не позволяет достичь системных эффектов проводимой терапии.
-
Рекомендуется использовать максимальные (для возраста) дозы антибактериальных препаратов системного действия для лечения детей и подростков с ГМИ при подозрении/подтверждении у них гнойного менингита с учетом проницаемости препарата через гематоэнцефалический барьер [1,4,26,30,60].
Уровень убедительности рекомендаций C (уровень достоверности доказательств–5)
Комментарии: Системное назначение высоких доз антибиотиков необходимо для обеспечения их терапевтических концентраций в интратекальном пространстве.
-
Рекомендуется введение антибактериальных препаратов системного действия на догоспитальном этапе только в случаях, веских подозрений на менингококковую инфекцию (наличие соответствующей клиники в сочетании с геморрагической сыпью), при обеспечении сосудистого доступа [4, 61].
Уровень убедительности рекомендаций C (уровень достоверности доказательств–5)
Комментарий: АБП должны вводиться только при наличии сосудистого доступа и налаженной инфузионной терапии, учитывая высокий риск развития гемодинамических нарушений (вплоть до СШ) в ответ на резкое повышение уровня эндотоксина при распаде менингококков под воздействием антибиотиков (антибактериальных препаратов системного действия), обладающих бактерицидным эффектом.
При отсутствии геморрагической сыпи, в случаях, предполагаемого БГМ, введение антибактериальных препаратов рекомендуется только при невозможности быстрой (до 90 мин) госпитализации пациента. При возможности быстрой транспортировки пациента в стационар, до начала эмпирической терапии, целесообразно провести забор материала для бактериологического исследования (кровь, ЦСЖ, мазки со слизистых носоглотки).
-
Рекомендуется в качестве этиотропных препаратов при лечении ГМИ использовать цефалоспорины III поколения (J01DD), карбапенемы (J01DH) (меропенем**) пенициллины, чувствительные к беталактамазам, комбинации пенициллинов, включая комбинации с ингибиторами беталактамаз [1,4,24,30,55].
Уровень убедительности рекомендаций В (уровень достоверности доказательств–2)
Комментарий: Менингококк сохраняет высокую чувствительность к пенициллинам (Бета-лактамным антибактериальным препаратам: пенициллинам), однако существуют данные о наличии штаммов с промежуточной устойчивостью к данной группе препаратов. На практике, в настоящее время «Бета-лактамные антибактериальные препараты: пенициллины» редко используются в качестве средств эмпирической терапии ГМИ, учитывая, что схожая клиника может наблюдаться и при тяжелых бактериальных инфекциях иной этиологии (гемофильной, пневмококковой и пр.).
В настоящее время цефалоспорины 3-го поколения являются препаратами первого выбора и стартовой эмпирической терапии и для ГМИ, и для бактериальных гнойных менингитов у взрослых и детей старше 1 мес. При назначении цефтриаксона** необходимо учитывать недопустимость его применения с растворами, содержащими кальций [53].
Меропенем** не является препаратом первой линии при ГМИ, назначается в случаях развития вторичных бактериальных осложнений у пациентов ОРИТ (с учетом чувствительности, выделенных возбудителей; препарат выбора для эмпирического назначения при выраженной нейтропении). Следует учитывать, что меропенем** снижает концентрацию вальпроатов в крови, что может приводить к рецидиву судорог у пациентов, получающих базовую терапию препаратами вальпроевой кислоты** [53].
-
Рекомендуется в качестве этиотропного препарата при лечении ГМИ у детей старше 3-х лет жизни использование хлорамфеникола [1,4,24,30, 60].
Уровень убедительности рекомендаций C (уровень достоверности доказательств–5)
Комментарий: Препарат назначается только в случаях документированных тяжелых аллергических реакций на препараты группы «бета-лактамные антибактериальные препараты: пенициллины)». Противопоказан у детей раннего возраста (до 3-х лет), при лейкопении. Обладает выраженной гематотоксичностью. У недоношенных и детей первого месяца жизни может развиваться кардиоваскулярный синдром «серый синдром» (голубовато-серый цвет кожи, пониженная температура тела, неритмичное дыхание, отсутствие реакций, сердечно-сосудистая недостаточность — летальность достигает 40%) [48].
Средства патогенетической терапии.
-
Рекомендуется в качестве патогенетической терапии применение препарата – «иммуноглобулин человека нормальный [IgG + IgM + IgA]** для внутривенного введения (АТХ J06BA02) [4,24,30,31,36, 99].
Уровень убедительности рекомендаций С (уровень достоверности доказательств–4)
Комментарии: Назначается с целью иммунокоррекции, учитывая значение в патогенезе развития вторичного иммунодефицита. Особенно показан при наличии в дебюте заболевания лейкопении. Применение иммуноглобулина человека нормального [IgG + IgM + IgA]** для внутривенного введения у детей с сепсисом и СШ, в первые трое суток от начала заболевания уменьшает число осложнений.
-
Не рекомендуется применение глюкокортикоидов у детей с установленной менингококковой этиологией менингита [62-68].
Уровень убедительности рекомендаций C (уровень достоверности доказательств–1)
Комментарии: Применение глюкокортикоидов (дексаметазона**) при бактериальных гнойных менингитах у детей не влияет на уровень летальности, однако снижает частоту развития сенсоневральной тугоухости при менингитах, вызванных гемофильной палочкой, при условии их введения до начала антибактериальной терапии. Положительных эффектов от назначения глюкокортикоидов при ММ не выявлено.
-
Рекомендуется использование глюкокортикоидов (гидрокортизона**) в качестве заместительной терапии у детей с ГМИ, осложненной развитием септического шока, резистентного к терапии адренергическими и дофаминергическими средствами [4,67,68].
Уровень убедительности рекомендаций C (уровень достоверности доказательств–5)
Комментарии: При развитии шока, резистентного к терапии адренергическими и дофаминергическими средствами (при развитии острой надпочечниковой недостаточности), применяется глюкокортикоид — гидрокортизон**: детям младше 6 лет — 1-2 мг/кг∙сут внутривенно болюсно или в виде постоянной инфузии. При развитии синдрома Уотерхауза-Фридериксена доза препаратов подбирается индивидуально.
Применение глюкокортикоидов с профилактической целью у детей с ГМИ без признаков СШ не показано.
-
Рекомендуется детям и подросткам с ГМИ проведение инфузионной терапии с использованием растворов для внутривенного введения (растворы, влияющие на водно-электролитный баланс- В05ВВ), препаратов плазмы крови и плазмозамещающих препаратов для поддержания/восполнения адекватного объема циркулирующей крови, КЩР, коррекции метаболических нарушений [4,24,25,30,31,69].
Уровень убедительности рекомендаций С (уровень достоверности доказательств–5)
Комментарии: Инфузионная терапия проводится больным с ГМИ. Объем и состав инфузионной терапии определяется ведущим клиническим синдромом, с учетом показателей лабораторного (КОС, уровень глюкозы) и функционального обследования (ЭКГ, ЭХО-КГ, ЦВД) мониторирования. В составе инфузионной терапии используют 0,9% раствор натрия хлорида**, раствор декстрозы**, растворы, влияющие на водно-электролитный баланс (В05ВВ): Калия хлорид + Натрия ацетат + Натрия хлорид**, натрия хлорида раствор сложный (Калия хлорид + Кальция хлорид +Натрия хлорид)**; кровезаменители и препараты плазмы крови (В05АА) [54,57, 60, 69].
-
Рекомендуется при развитии ОГМ использование растворов с осмодиуретическим действием [4,24,25,30,31,77].
Уровень убедительности рекомендаций С (уровень достоверности доказательств–5)
Комментарий: При отсутствии гипернатриемии, ОПН применяют маннитол**(В05ВС) под контролем ЦВД.
-
Рекомендуется при развитии СШ, рефрактерного к жидкостной нагрузке, использование препаратов группы кардиотонических средств, кроме сердечных гликозидов [4,24,25,30,31, 32, 70-76].
Уровень убедительности рекомендаций C (уровень достоверности доказательств–5).
Комментарии: септический шок – критическое состояние; в зависимости от клинической ситуации применяются адренергические и дофаминергические средства (C01CA) в различных сочетаниях, дозы подбираются индивидуально.
-
Рекомендуется в состав патогенетической терапии детям с ГМИ включать препараты, обладающие комплексным действием, в том числе антиоксидантным, антигипоксическим, метаболическим, нейропротективным, ноотропным [4,24].
Уровень убедительности рекомендаций С (уровень достоверности доказательств–5)
Комментарий: Применяются препараты, разрешенные в педиатрической практике, с учетом периода заболевания.
Средства симптоматической терапии.
-
Рекомендуется применение нестероидных противовоспалительных и противоревматических препаратов (НПВП) при лихорадке выше 38,5оС, при наличии болевого синдрома [4,24,25,31,54].
Уровень убедительности рекомендаций С (уровень достоверности доказательств–5).
Комментарии: В педиатрической практике допустимо применение производного пропионовой кислоты (ибупрофена**) и препарата группы анилидов (парацетамол**) в возрастных дозировках [57,58].
-
Рекомендуется при наличии судорожного синдрома применение противоэпилептических препаратов [78,79].
Уровень убедительности рекомендаций C (уровень достоверности доказательств–5)
Комментарии: Стартовая терапия с догоспитального этапа проводится с использованием производных бензадиазепинов N05BA (диазепам**), на госпитальном этапе в зависимости от длительности и характера приступов используют различные противоэпилептические препараты (N03A), наиболее часто используются препараты вальпроевой кислоты** (N03AG01), барбитураты и их производные -N03AA) [57,58].
3.2. Хирургическое лечение
-
Рекомендуется применение методов экстракорпоральной гемокоррекции при ГМИ, сопровождающейся СШ, развитием синдрома Уотерхаузе-Фридериксена [4, 80, 81].
Уровень убедительности рекомендаций C (уровень достоверности доказательств–3).
Комментарии: Применяются различные методы продленной почечно-заместительной терапии; методом выбора при СШ у детей является продленная вено-венозная гемодиафильтрация. Включение метода полимиксиновой адсорбции в схему экстракорпоральной терапии способствует адсорбции на колонке липополисахарида, являющегося триггером в патогенезе ГМИ.
-
Рекомендуется проведение хирургической обработки у пациентов с массивным поражением кожи и мягких тканей. [4,82].
Уровень убедительности рекомендаций C (уровень достоверности доказательств–5).
Комментарии: Хирургические методы применяются при необходимости некрэктомии, дренирования гнойных очагов (в случаях вторичного инфицирования мягких тканей); при развитии глубоких некрозов, мумификации дистальных отделов конечностей.
-
Рекомендуется госпитализация пациента в отделение реанимации и интенсивной терапии, перевод на ИВЛ при наличии рефрактерного СШ и/или церебральной недостаточности (менее 9 баллов по шкале ком Глазго), некупируемом судорожном статусе [30,78, 79].
Уровень убедительности рекомендаций C (уровень достоверности доказательств –5).
Комментарии: При необходимости проведения агрессивной жидкостной терапии перевод на ИВЛ обусловлен угрозой развития отека легких, при признаках церебральных нарушений в целях церебропротекции. как метод, способствующий купированию ВЧГ.
-
Рекомендуется проведение ультрафиолетового облучение кожи при наличии обширных некрозов [4].
Уровень убедительности рекомендаций С (уровень достоверности доказательств–5).
Комментарий: Профилактика бактериальных осложнений, стимуляция репаративных процессов.
-
Рекомендуется детям с локализованными формами МИ проведение КУФ зева и носа, лазеротерапия [4].
Уровень убедительности рекомендаций С (уровень достоверности доказательств–5).
Комментарий: Для ускорения элиминации возбудителя.
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
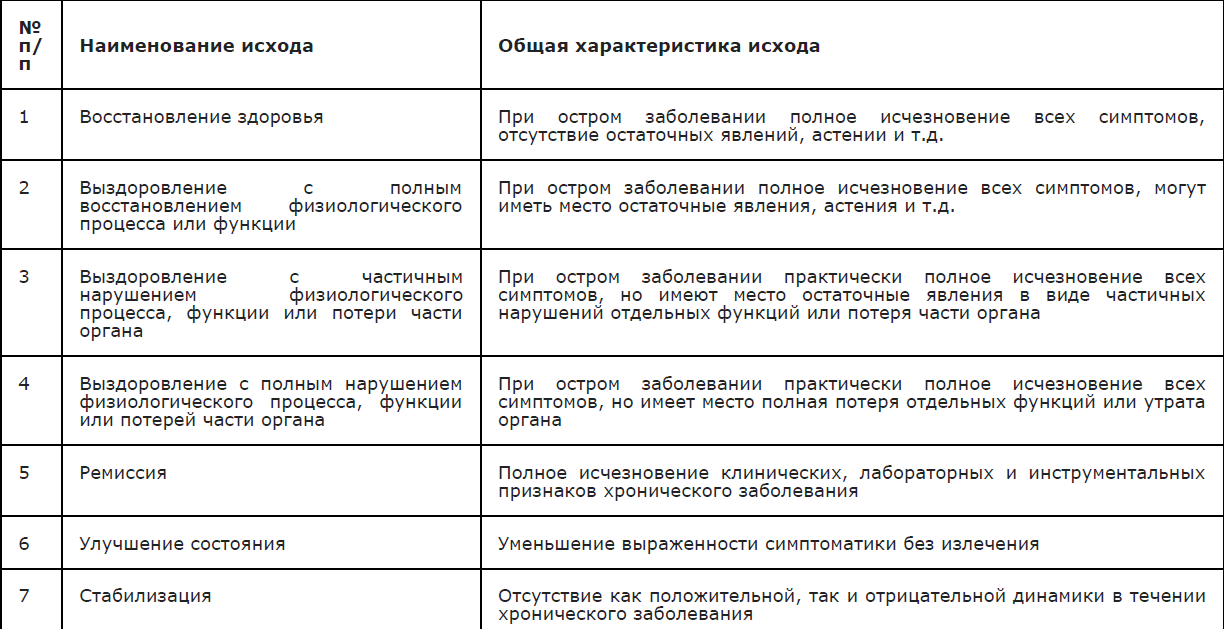
Возможные исходы ГМИ и их характеристика (Таблица 2).
Таблица 2 . Возможные исходы и их характеристика
Медицинская реабилитация
4. Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
Основные принципы реабилитации:
Реабилитационные мероприятия при ГМИ должны начинаться с острого периода заболевания и продолжаться в периоде реконвалесценции; необходимо соблюдать последовательность и преемственность проводимых мероприятий, обеспечивающих непрерывность на различных этапах реабилитации и диспансеризации.
Медицинская реабилитация осуществляется в медицинских организациях государственной системы здравоохранения или их соответствующих структурных подразделениях медицинских организаций, включая центры восстановительной медицины и реабилитации, а также санаторно-курортное лечение по профилю.
Госпитализация
6. Организация оказания медицинской помощи
Выбор условий оказания медицинской помощи (амбулаторно/стационарно), методы и объем терапии МИ определяются клинической формой заболевания, степенью тяжести, наличием осложнений.
Показаниями для госпитализации в медицинскую организацию при МИ являются:
— подозрение на генерализованную форму МИ;
— необходимость изоляции пациента с локализованной формой по эпидемиологическим показаниям;
— указанием на серьезные аллергические реакции на антибиотики анамнезе .
В амбулаторных условиях рекомендуется лечение больных с локализованными формами МИ (менингококковый назофарингит, носительство менингококка).
Комментарий: Противопоказанием к амбулаторному лечению является необходимость изоляции пациента по эпидемиологическим показаниям (при наличии в квартире детей дошкольного возраста, для воспитанников домов ребенка, психо-неврологических интернатов и пр.).
- Рекомендуется при подозрении на ГМИ экстренная госпитализация пациента в стационар, имеющий в структуре отделения/палаты реанимации и интенсивной терапии, где может быть оказана специализированная помощь [1,4,24,30].
Уровень убедительности рекомендаций С (уровень достоверности доказательств –5).
Комментарии: Учитывая высокий риск быстрого возникновения жизнеугрожающих состояний при ГМИ, госпитализация должна осуществляться в ОРИТ (или палаты интенсивной терапии) для интенсивного наблюдения и осуществления неотложных/реанимационных мероприятий до стабилизации состояния.
Показания к выписке пациента из медицинской организации
1) Клиническое выздоровление
2) Нормализация лабораторных показателей
Профилактика
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Профилактические мероприятия при МИ подразделяются на неспецифические и специфические.
5.1. Неспецифическая профилактика
Неспецифическая профилактика проводится согласно СанПиН 3.3686-21. «Санитарно-эпидемиологические требования по профилактике инфекционных болезней» Профилактические мероприятия в очаге направлены на активное выявление и изоляцию больных до полного у них исчезновения симптомов.
После госпитализации больного с ГМИ или с подозрением на нее наложение карантина в очаге сроком на 10 дней.
Проводится осмотр врача-отоларинголога лиц, находившихся в тесном контакте с заболевшим с целью выявления больных острым назофарингитом.
Назначается бактериологическое обследование, выявленных острым назофарингитом больных до назначения им соответствующего лечения.
- Рекомендуется проведение экстренной химиопрофилактики лицам, находившимся в тесном контакте с больным МИ с использованием антибактериальных препаратов системного действия (J01) [29,54-59, 83-86].
Уровень убедительности рекомендаций C (уровень достоверности доказательств–5)
Комментарии: согласно СП3.1.3542-18 «Профилактика менингококковой инфекции» для профилактики МИ применяется рифампицин** ( старше 12 месяцев по 10 мг/кг, до 1 года — по 5 мг/кг, через каждые 12 часов в течение 2 дней); цефтриаксон** 125 мг в/м, однократно [83, 84].
5.2. Специфическая профилактика менингококковой инфекции
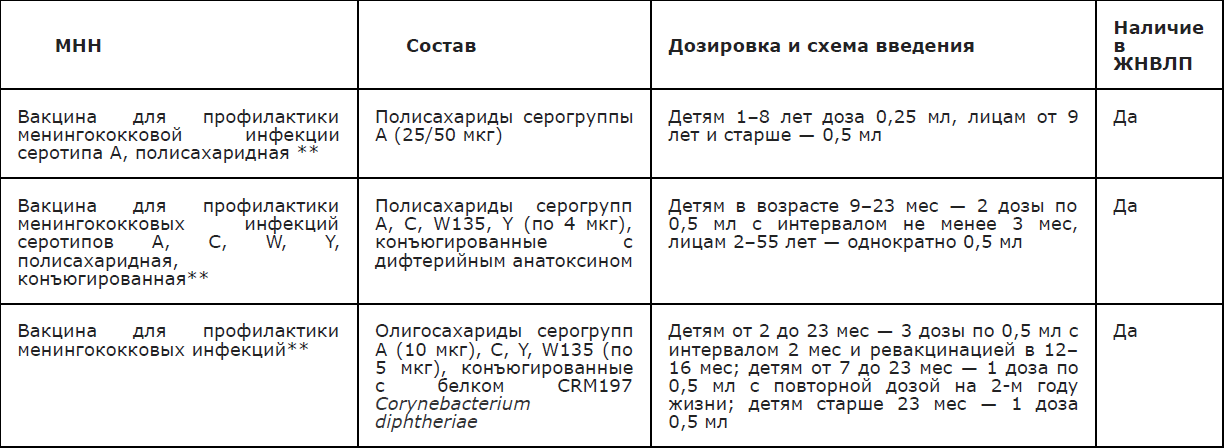
- Рекомендуется в межэпидемический период проведение вакцинации в плановом порядке лиц из групп высокого риска инфицирования, а также по эпидемическим показаниям — лиц, контактировавших с больным в очагах ГМИ [29, 87-96].
Уровень убедительности рекомендаций C (уровень достоверности доказательств–5).
Комментарии: Группы риска по развитию ГМИ, подлежащие вакцинации в межэпидемический период:
• лица, подлежащие призыву на военную службу;
• лица, отъезжающие в эндемичные по менингококковой инфекции районы (например, паломники, военнослужащие, туристы, спортсмены, геологи, биологи);
• медицинские работники структурных подразделений, оказывающих специализированную медицинскую помощь по профилю «инфекционные болезни»;
• медицинские работники и сотрудники лабораторий, работающих с живой культурой менингококка;
• воспитанники и персонал учреждений стационарного социального обслуживания с круглосуточным пребыванием (дома ребенка, детские дома, интернаты);
• лица, проживающие в общежитиях;
• лица, принимающие участие в массовых международных спортивных и культурных мероприятиях;
• дети до 5 лет включительно (в связи с высокой заболеваемостью в данной возрастной группе);
• подростки в возрасте 13 — 17 лет (в связи с повышенным уровнем носительства возбудителя в данной возрастной группе);
• лица старше 60 лет;
• лица с первичными и вторичными иммунодефицитными состояниями, в том числе ВИЧ-инфицированных;
• лица, перенесшие кохлеарную имплантацию;
• лица с ликвореей.
— В очаге лицам, общавшимся с больным ГФМИ, проводится экстренная специфическая профилактика актуальной вакциной (в соответствии с серогруппой менингококка, выделенного из ликвора и (или) крови больного ГФМИ). В случае отсутствия возможности проведения определения серогруппы менингококка, экстренную иммунопрофилактику проводят без ее установления многокомпонентными вакцинами. Иммунизация контактных лиц проводится в соответствии с инструкцией по применению вакцины. Проведение химиопрофилактики не является противопоказанием для иммунизации.
- Рекомендуется в период эпидемического подъема заболеваемости МИ в очагах ГФМИ, лицам, общавшимся с больным, проведение экстренной иммунопрофилактики многокомпонентными вакцинами (Приложения А4.1, А4.2) [29,86, 89 — 92].
Уровень убедительности рекомендаций С (уровень достоверности доказательств–5).
Комментарии: Предвестниками осложнения эпидемиологической ситуации являются:
• увеличение заболеваемости ГФМИ в 2 раза по сравнению с предыдущим годом;
• увеличение доли детей старшего возраста, подростков и лиц в возрасте 18 — 25 лет в общей возрастной структуре, заболевших в 2 раза;
• выраженный (в 2 и более раз) рост случаев заболеваний в дошкольных образовательных, общеобразовательных организациях, среди студентов первых курсов профессиональных образовательных организаций и образовательных организаций высшего образования (например, среди приезжих студентов, проживающих в общежитиях);
• появление очагов с двумя и более случаями заболеваний ГФМИ;
• постепенное изменение серогрупповой характеристики штаммов менингококка, выделенных из ликвора и (или) крови больных ГФМИ и формирование многопрофильного по серогрупповой характеристике пейзажа штаммов менингококка с одновременным увеличением показателей заболеваемости.
- Рекомендуется проведение профилактической вакцинации по эпидемическим показаниям: детям от 1 года до 8 лет включительно; студентам первых курсов средних и высших учебных заведений (прежде всего в коллективах, укомплектованных учащимися из разных регионов страны и зарубежных стран) [90, 91, 92].
Уровень убедительности рекомендаций С (уровень достоверности доказательств–4).
Комментарии: При продолжающемся росте заболеваемости менингококковой инфекцией число прививаемых лиц по эпидемическим показаниям должно быть расширено:
за счет учащихся 3–11-х классов; взрослого населения при обращении для проведения иммунизации против менингококковой инфекции в лечебно-профилактические организации.
Противопоказаниями к проведению вакцинации менингококковыми вакцинами являются:
• выраженные, тяжелые системные реакции на предыдущее введение вакцины (анафилактические реакции);
• гиперчувствительность к любому компоненту вакцины;
• острые инфекционные заболевания или обострение хронического процесса.
Вакцинацию можно проводить через 1–2 недели по достижении ремиссии или выздоровления от острого инфекционного заболевания.
1.За лицами, перенесшими локализованные формы менингококковой инфекции, диспансерное наблюдение не устанавливается.
2.За больными, перенесшими тяжелую форму менингококкемии сроки диспансерного наблюдения и перечень необходимых обследований и осмотров специалистов зависит от ведущих патологических синдромов в остром периоде заболевания.
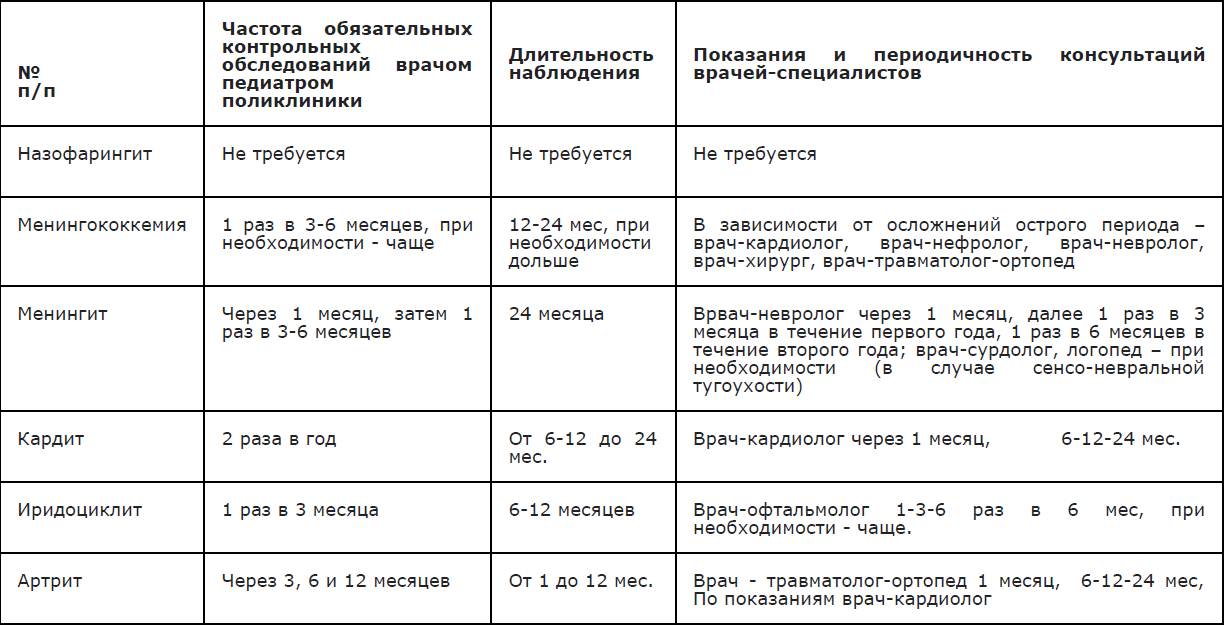
- Рекомендуется осуществлять диспансерное наблюдение за детьми, перенесшими менингококковую инфекцию с менингитом и/или менингоэнцефалитом, у невропатолога детской поликлиники в течение 2-х лет [4].
Уровень убедительности рекомендаций С (уровень достоверности доказательств–5).
Комментарии: Сроки диспансерного наблюдения после выписки из стационара: через 1 месяц, далее 1 раз в 3 месяца в течение первого года, 1 раз в 6 месяцев в дальнейшем, при необходимости частота осмотров увеличивается.
Таблица1. Порядок диспансерного наблюдения реконвалесцентов ГМИ
Информация
Источники и литература
-
Клинические рекомендации Межрегиональной общественной организации «Ассоциация врачей-инфекционистов Санкт-Петербурга и Ленинградской области»
- 1. Покровский В.И., Фаворова Л.А., Костюкова Н.Н. Менингококковая инфекция. – М., 1996.
2. Brandtzaeg P., van Deuren M. Classification and pathogenesis of meningococcal infections. Methods Mol Biol. 2012; 799:21-35.
3. Королева И.С.. Белошицкий Г.В., Королева М.А. Менингококковая инфекция и бактериальные гнойные менингиты в Российской Федерации: десятилетнее эпидемиологическое наблюдение// Эпидем и ифекц.болезни.Актуальн.вопросы.-2013.-№2.-с.15-20.
4. Скрипченко Н.В., Вильниц А.А. Менингококковая инфекция у детей/Руководство для врачей./ СПб.-ТактикСтудио.-2015.-840с.
5. Miller F., Lécuyer H., Join-Lambert O. et al. Neisseria meningitidis colonization of the brain endothelium and cerebrospinal fluid invasion, Cellular Microbiology 15(4), 2013; 512–519.
6. Pathan N., Faust S.N., Levin M. Pathophysiology of meningococcal meningitis and septicaemia. Arch Dis Child. 2003; 88(7):601-7.
7. Brouwer MC, Read RC, van de Beek D. Host genetics and outcome in meningococcal disease: a systematic review and meta-analysis. Lancet Infect Dis. 2010;10:262–274.in variants. PLoS One. 2012;7:e49295.
8. Hodeib S, Herberg JA, Levin M, Sancho-Shimizu V. Human genetics of meningococcal infections. //Hum Genet. 2020 Jun;139(6-7):961-980. doi: 10.1007/s00439-020-02128-4.
9. Rodenburg GD, Fransen F, Bogaert D, et al. Prevalence and clinical course in invasive infections with meningococcal endotoxin variants. PLoS One. 2012;7(11):e49295.
10. Hellerud BC, Olstad OK, Nielsen EW, et al. Massive Organ Inflammation in Experimental and in Clinical Meningococcal Septic Shock. Shock. 2015;44(5):458-469.
11. Antonucci E, Fiaccadori E, Donadello K, Taccone FS, Franchi F, Scolletta S. Myocardial depression in sepsis: from pathogenesis to clinical manifestations and treatment. J Crit Care. 2014;29:500–511.
12. Hellum M, Ovstebo R, Brusletto BS, Berg JP, Brandtzaeg P, Henriksson CE. Microparticle associated tissue factor activity correlates with plasma levels of bacterial lipopolysaccharides in meningococcal septic shock. Thromb Res. 2014;133:507–514.
13. О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2021 году: Государственный доклад. М.: Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека, 2022. 340 с
14. Лобзин Ю.В., Скрипченко Н.В., Вильниц А.А. и др. Гнойные менингиты у детей в мегаполисе: клинико-эпидемиологические аспекты за период 1990-2017 гг. //Инфекционные болезни, 2019.-N 1.-С.12-19.
15. Нагибина М.В., Венгеров Ю.Я., Матосова С.В. и др. Генерализованная форма форма менингококковой инфекции, вызванная N. meningitidis серогруппы W, на территории г. Москвы в 2011-2016 гг. // Инфекционные болезни. Новости. Лечение. Обучение, 2018.-N 1.-С.100-105
16. Лобзин Ю.В., Иванова М.В., Скрипченко Н.В. и др. Современные клинико-эпидемиологические особенности течения генерализованной менингококковой инфекции и новые возможности терапии // Инфекционные болезни. Новости. Лечение. Обучение., 2018.-N 1.-С.69-77.
17. Лобзин Ю.В.,Скрипченко Н.В., Маркова и др. Семейные случаи менингококковой инфекции, вызванной Neisseria meningitidis серогруппы W //Педиатрия .- 2019.-N 1.-С.242-245
18. van Kessel F., van den Ende C., Oordt-Speets A.M. et al.Outbreaks of meningococcal/ meningitis in non-African countries over the last 50 years: a systematic review//J Glob Health. 2019 Jun; 9(1): 010411. doi: 10.7189/jogh.09.010411.
19. Krone M, Gray S, Abad R. et al. Increase of invasive meningococcal serogroup W disease in Europe, 2013 to 2017.// Euro Surveill. 2019 24(14):1800245.
20. Christensen H., May M., Bowen L., Hickman M., Trotter C.L. Meningococcal carriage by age: a systematic review and meta-analysis. Lancet Infect Dis. Dec 2010; 10(12):853-61.
21. Вильниц А.А., Скрипченко Н.В., Карев В.Е. и др. Особенности течения бактериальных гнойных менингитов с летальным исходом ретроспективный анализ 125 случаев заболевания у детей // Инфекционные болезни, 2017.-2017.-С19-24
22. B. Wang et al. Case fatality rates of invasive meningococcal disease by serogroup and age: A systematic review and meta-analysis/ Vaccine 37 (2019) 2768–2782
23. M. Troendle, D. Willis / Fulminant bacterial meningitis due to Neisseria meningitidis with no pleocytosis on lumbar puncture American Journal of Emergency Medicine 35 (2017) 198.e1–198.e2
24. Bacterial meningitis and meningococcal septicaemia. Management of bacterial meningitis and meningococcal septicaemia in children and young people younger then 16 years in primary and secondary care. NICE.-Clinical guideline no102.-2010/-45p.
25. Guidelines for the Early Clinical and Public Health Management of Bacterial Meningitis (including Meningococcal Disease) Report of the Scientific Advisory Committee of HPSC, 2012
26. Pelton S, Sadarangani M, Glennie L, Levin M. Clinical aspects of meningococcal disease. In: Feavers IPA, Sadarangani M, editors. Handbook of meningococcal disease management. New York: Springer; 2016
27. Stein-Zamir C, Shoob H, Sokolov I, Kunbar A, Abramson N, et al. The clinical features and longterm sequelae of invasive meningococcal disease in children. Pediatr Infect Dis J. 2014;33(7):777–9
28. Feldman C, Anderson R. Meningococcal pneumonia: a review. //Pneumonia (Nathan). 2019 25;11:3.
29. Санитарно-эпидемиологические правила СП 3.1.3542-18 «Профилактика менингококковой инфекции» 19.01.2019
30. Dellinger R.P., Levy M.M., Rhodes A., et al Surviving Sepsis Campaign Guidelines Committee including the Pediatric Subgroup. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012 // Crit. Care Med. 2013. Vol. 41(2). P. 580– 637.
31. Kneyber MCJ. Hematologic Emergencies in the PICU. Pediatric Critical Care Medicine. 2014 May 28:287–96. doi: 10.1007/978-1-4471-6416-6_20. PMCID: PMC7122033.
32. Александрович Ю.С., Пшениснов К.В. Современные принципы диагностики и интенсивной терапии септического шока у детей// Росс.вестник детской хирургии, анестезиологии и реанимации, 2011.-№3.-С.31-35.
33. Лабораторная диагностика менингококковой инфекции и гнойных бактериальных менингитов: Методические указания. –МУК 4.2.1887-04.
Annals of Intensive Care 2013, 3:12 doi:10.1186/2110-5820-3-12.
35. De Jong A. van Oers, J.A. et al. Efficacy and safety of procalcitonin guidance in reducing the duration of antibiotic treatment in critically ill patients: a randomised, controlled, open-label trial// The Lancet Infectious Diseases. — 2016. — №7. – P. 1-9
36. Charles P.E, Ladoire S., Aho S.Serum procalcitonin elevation in critically ill patients at the onset 128 of bacteremia caused by either Gram negative or Gram positive bacteria.//BMC Infect Dis. 2008; 8:38.
37. Tansarli GS, Chapin KC. Diagnostic test accuracy of the BioFire FilmArray®meningitis/encephalitis panel: a systematic review and meta-analysis. Clin Microbiol Infect 2020;26:281-90. doi: 10.1016/j.cmi.2019.11.016
38. Trujillo-Gómez J, Tsokani S, Arango-Ferreira C et al. Biofire FilmArray Meningitis/Encephalitis panel for the aetiological diagnosis of central nervous system infections: A systematic review and diagnostic test accuracy meta-analysis. EClinicalMedicine. 2022 Feb 14;44:101275. doi: 10.1016/j.eclinm.2022.101275. PMID: 35198914; PMCID: PMC8851290.
39. Posnakoglou L et al. Impact of cerebrospinal fluid syndromic testing in the management of children with suspected central nervous system infection. Eur J Clin Microbiol Infect Dis. 2020 Dec;39(12):2379-2386. doi: 10.1007/s10096-020-03986-6.
40. Cailleaux M, Pilmis B, Mizrahi A et al. Impact of a multiplex PCR assay (FilmArray®) on the management of patients with suspected central nervous system infections. Eur J Clin Microbiol Infect Dis. 2020 Feb;39(2):293-297. doi: 10.1007/s10096-019-03724-7.
- 1. Покровский В.И., Фаворова Л.А., Костюкова Н.Н. Менингококковая инфекция. – М., 1996.
Информация
АБТ – антибактериальная терапия
АСВП – акустические стволовые вызванные потенциалы
БГМ – бактериальные гнойные менингиты
ВВИГ – внутривенные иммуноглобулины
ВОЗ – Всемирная организация здравоохранения
ВСК – время свертывания крови
ВЧГ – внутричерепная гипертензия
ГМИ – генерализованная менингококковая инфекция
ДВС-с-м – синдром диссеминированного внутрисосудистого свертывания
ДН – дыхательная недостаточность
ДК – длительность кровотечения
ЖНВЛП — жизненно необходимые и важнейшие лекарственные препараты
ИТ – инфузионная терапия
КТ – компьютерная томография
МИ – менингококковая инфекция
ММ – менингококковый менингит
МРТ – магнитно-резонансная томография
НСГ – нейросонография
ОГМ – отек головного мозга
ОССН – острая сердечно-сосудистая недостаточность
ОЦК – объем циркулирующей крови
ПКТ – прокальцитонин
ПЦР – полимеразная цепная реакция
РЛА – реакция агглютинации латекса
СРБ – С –реактивный белок
СДВ – субдуральный выпот
СНСАДГ – синдром неадекватной секреции антидиуретического гормона
СНТ – сенсоневральная тугоухость
СПОН – синдром полиорганной недостаточности
СП- спинномозговая пункция
ССВР – синдром системной воспалительной реакции
СШ – септический шок
ТКДГ – транскраниальная допплерография
ЧД – частота дыхания
ШИ – шоковый индекс
ЧСС – частота сердечных сокращений
ФП – физиологическая потребность
ЦСЖ- цереброспинальная жидкость
ЦНС – центральная нервная система
ЦС – цефалоспорины
ЭКГ – электрокардиограмма
ЭЭГ – электроэнцефалограмма
PELOD – Pediatric Logistic Organ Dysfunction (логистическая система оценки органной дисфункции в педиатрии)
SOFA – Sequential Organ Failure Assessment (динамическая оценка органной недостаточности)
** – лекарственный препарат, входящий в Перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения на 2020 год (Распоряжение Правительства РФ от 12.10.2019 № 2406-р)
Алгоритм — набор инструкций, описывающих порядок действий исполнителя для достижения некоторого результата.
Визуализация — метод и процесс создания визуальных представлений внутренних структур тела для клинического анализа и медицинского вмешательства, а также визуального представления функций некоторых органов или тканей.
Заболевание – возникающее в связи с воздействием патогенных факторов нарушение деятельности организма, работоспособности, способности адаптироваться к изменяющимся условиям внешней и внутренней среды при одновременном изменении защитно-компенсаторных и защитно-приспособительных реакций и механизмов организма.
Заболеваемость — медико-статистический показатель, определяющий число заболеваний, впервые зарегистрированных за календарный год среди населения, проживающего на какой-то конкретной территории. Является одним из критериев оценки здоровья населения.
Качество медицинской помощи – совокупность характеристик, отражающих своевременность оказания медицинской помощи, правильность выбора методов профилактики, диагностики, лечения и реабилитации при оказании медицинской помощи, степень достижения запланированного результата.
Клинические рекомендации оказания медицинской помощи детям – нормативный документ системы стандартизации в здравоохранении, определяющий требования к выполнению медицинской помощи больному при определенном заболевании, с определенным синдромом или при определенной клинической ситуации.
Клиническая ситуация – случай, требующий регламентации медицинской помощи вне зависимости от заболевания или синдрома.
Основное заболевание – заболевание, которое само по себе или в связи с осложнениями вызывает первоочередную необходимость оказания медицинской помощи в связи с наибольшей угрозой работоспособности, жизни и здоровью, либо приводит к инвалидности, либо становится причиной смерти.
Тяжесть заболевания или состояния – критерий, определяющий степень поражения органов и (или) систем организма человека либо нарушения их функций, обусловленные заболеванием или состоянием либо их осложнением.
Уровень достоверности доказательств – отражает степень уверенности в том, что найденный эффект от применения медицинского вмешательства является истинным.
Факторы риска — любые предрасполагающие факторы, увеличивающие вероятность возникновения или ухудшения болезни.
Критерии оценки качества медицинской помощи
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
1. Лобзин Ю.В., Заслуженный деятель науки Российской Федерации, доктор медицинских наук профессор, академик РАН, Президент Федерального государственного бюджетного учреждения «Детский научно-клинический центр инфекционных болезней Федерального медико-биологического агентства» (ДНКЦИБ), заведующий кафедрой инфекционных болезней СЗГМУ им. И.И. Мечникова, Президент Евро-Азиатского общества по инфекционным болезням, заместитель Председателя национального научного общества инфекционистов, Председатель правления Ассоциации врачей-инфекционистов Санкт-Петербурга и Ленинградской области
2. Скрипченко Н.В., Заслуженный деятель науки Российской Федерации, доктор медицинских наук профессор, заместитель директора по научной работе ФГБУ ДНКЦИБ ФМБА России, заведующая кафедрой инфекционных заболеваний у детей Факультета последипломного и дополнительного профессионального образования Санкт-Петербургского Государственного Педиатрического Медицинского Университета, член национального научного общества инфекционистов, член Правления Всероссийской ассоциации неврологов, член Правления Санкт-Петербургского отделения Союза педиатров России
3. Харит С.М., доктор медицинских наук, профессор, ведущий научный сотрудник, руководитель отдела профилактики инфекционных заболеваний ФГБУ ДНКЦИБ ФМБА России, профессор кафедры инфекционных заболеваний у детей Факультета последипломного и дополнительного профессионального образования Санкт-Петербургского Государственного Педиатрического Медицинского Университета, член национального научного общества инфекционистов
4. Вильниц А.А., доктор медицинских наук, заведующая научно-исследовательским отделом интенсивной терапии неотложных состояний, старший научный сотрудник отдела нейроинфекций и органической патологии нервной системы ФГБУ ДНКЦИБ ФМБА России, доцент кафедры инфекционных заболеваний у детей Факультета последипломного и дополнительного профессионального образования Санкт-Петербургского Государственного Педиатрического Медицинского Университета, член национального научного общества инфекционистов
5. Горелик Е.Ю., кандидат медицинских наук, старший научный сотрудник, и.о. руководителя отдела нейроинфекций и органической патологии нервной системы ФГБУ ДНКЦИБ ФМБА России, член национального научного общества инфекционистов
Разработчики клинических рекомендаций подтверждают отсутствие финансовой поддержки/конфликта интересов.
Приложение А2. Методология разработки клинических рекомендаций
Методология
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных.
Целевая аудитория данных клинических рекомендаций:
1. врач-анестезиолог-реаниматолог;
2. врач здравпункта;
3. врач-инфекционист;
4. врач-невролог;
5. врач общей практики (семейный врач);
6. врач-педиатр;
7. врач-педиатр городской (районный);
8. врач-педиатр участковый;
9. врач по медицинской профилактике;
10. врач по медицинской реабилитации;
11. врач приемного отделения;
12. врач-терапевт подростковый;
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года,а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Приложение А3.1 Нормативные документы
1 Федеральный закон от 21.11.2011 N 323-ФЗ (ред. от 02.07.2021) «Об основах охраны здоровья граждан в Российской Федерации»(Собрание законодательства Российской Федерации, 2011, № 48, ст. 6724) (с изм. и доп., вступ. в силу с 01.10.2021) (https://roszdravnadzor.gov.ru/documents/100)
2 Приказ Минздравсоцразвития России от 5 мая 2012г. № 521н (ред. от 21.02.2020) “Об утверждении Порядка оказания медицинской помощи детям с инфекционными заболеваниями”, зарегистрирован в Минюсте РФ 10 июля 2012г., регистрационный №24867; (https://docs.cntd.ru/document/902348291)
4 Приказ Минздрава России от 16.05.2019г. №302н (ред. от 19.11.2020) «Об утверждении порядка прохождения диспансерного наблюдения в том числе в период обучения и воспитания в образовательных организациях»; (Зарегистрировано в Минюсте России 07.06.2019 N 54887) (https://docs.cntd.ru/document/554715762) ;
5 Международная классификация болезней, травм и состояний, влияющих на здоровье (МКБ – 10) (https://mkb-10.com/);
6 Постановление Главного государственного санитарного врача РФ от 28.01.2021 N 4
7 «Об утверждении санитарных правил и норм СанПиН 3.3686-21 «Санитарно-эпидемиологические требования по профилактике инфекционных болезней» (вместе с «СанПиН 3.3686-21. Санитарные правила и нормы «Санитарно-эпидемиологические требования по профилактике инфекционных болезней»») (Зарегистрировано в Минюсте России 15.02.2021 N 62500)
8 Приложение N 1 к распоряжению Правительства Российской Федерации от 12.10.2019 г. (в ред. распоряжений Правительства РФ от 12.10.2020 N 2626-р, от 23.11.2020 N 3073-р) «Перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения» (https://roszdravnadzor.gov.ru/spec/drugs/documents/64966)
Приложение А3.3 Осложнения менингококковой инфекции
Приложение А3.4 Критерии диагностики синдрома системной воспалительной реакции (ССВР) АССР/SCCM (1992), IPSSC, 2005г
Приложение А3.5 Возраст-специфические пороговые диагностические значения ССВР
Приложение А 3.6 Опорно-диагностические признаки при клинической диагностике септического шока
Септический шок должен быть заподозрен, если у больного присутствуют следующие симптомы:
· Гипо или гипертермия (температура <36 или>38,5оС)
· Тахипноэ
· Нарушение ментального статуса (необычная вялость, безразличие, сонливость, сопор, кома или возбуждение, раздражительность с оценкой сознания по шкале ком Глазго для детей)
· Снижение диуреза менее 1 мл/кг/мин
· Признаки нарушения микроциркуляции (изменение цвета и температуры кожных покровов, время капиллярного наполнения)
Приложение А3.7 Клинические признаки «холодного» и «теплого» шоков.
Примечание: * Капиллярное наполнение у детей исследуют путем надавливания на кожу в области центральной части грудины в течение 5 секунд с последующей оценкой времен реперфузии, которая в норме составляет 2-3 секунды.
Приложение А3.8 Опорно-диагностические признаки при клинической диагностике отека головного мозга
· Нарушение сознания (менее 9-10 баллов ШКГ) или его колебания
· Ненормальная двигательная реакция на раздражение
· Патологическая поза
· Нарушение реакции зрачков на свет
· Диспноэ
· Сочетание артериальной гипертензии, брадикардии, диспноэ (триада Кушинга)
· Судорожный статус
· Очаговая неврологическая симптоматика
Приложение А3.9 Стадии развития эпилептического статуса
Примечание: Дифференциальный диагноз судорожного ЭС проводится с ознобом при сепсисе, миоклоническими гиперкинезами, генерализованной дистонией и псевдоЭС.
Приложение А3.10 Противопоказания для проведения спинномозговой пункции
· нарушение уровня сознания (ШКГ менее 9 баллов) или флюктуирующее сознание
· относительная брадикардия и гипертензия,
· очаговая неврологическая симптоматика,
· судороги
· нестабильная гемодинамика,
· неадекватная реакция зрачков на свет, синдром «кукольных глаз»,
· септический шок,
· прогрессирующая геморрагическая сыпь,
· нарушения гемостаза,
· уровень тромбоцитов менее 100 х109/л,
· проводимая антикоагулянтная терапия,
· локальная инфекция кожи и мягких тканей в зоне проведения люмбальной пункции,
· дыхательная недостаточность
Транспортировка/госпитализация больно с нарастающей внутричерепной гипертензией (ВЧГ)/ОГМ в связи с возможностью развития жизнеугрожающих состояний должна осуществляться только бригадой РКЦ при условии проведения ИВЛ.
Приложение А.3.11 Дифференциальная диагностика менингококцемии с другими заболеваниями, протекающими с кожными высыпаниями
Приложение А3.12. Средства специфической профилактики менингококковой инфекции. Вакцины для профилактики менингококковой инфекции, зарегистрированные в Российской Федерации
Приложение А3.13. Сравнительная характеристика полисахаридных и конъюгированных вакцин
Приложение Б. Алгоритмы действий врача
Приложение В. Информация для пациента
Менингококковая инфекция — это острое инфекционное заболевание, вызываемое различными видами менингококка. Характеризуется многообразием клинических проявлений: от назофарингита (воспаление слизистой оболочки носа и зева) и бактерионосительства до распространенных, тяжело протекающих в форме менингококкемии (наличие менингококковой инфекции в крови), менингита и менингоэнцефалита (воспаление оболочек головного мозга).
Возбудителем менингококковой инфекции является грамположительный диплококк Neisseria meningitides. Менингококковой инфекцией заражаются и болеют только люди. Наиболее распространена инфекция среди детей: до 80% от числа всех больных. Подвержены заболеванию дети любого возраста, особенно часто инфекция поражает детей на первом году жизни.
Источником инфекции может быть только больной человек или бактерионоситель. Менингококковая инфекция распространяется воздушно-капельным путем через зараженные капельки слизи, выделяемые из носоглотки и верхних дыхательных путей. Часто дети раннего возраста заражаются от родителей, близких родственников, которые являются либо носителями, либо больными локализованной формой инфекции.
Инкубационный период может длиться от 2 до 10 дней, обычно он короткий: равен 2-3 дням. Локализованные формы диагностируются только при бактериологическом исследовании. Наибольшую опасность представляют генерализованные формы: менингококковый сепсис (менингококцемия), менингит (воспаление оболочек мозга); менингоэнцефалит (воспаление и оболочек, и вещества мозга); часто имеет место сочетание проявлений сепсиса и менингита. Бессимптомное менингококконосительство – самая частая форма заболевания (развивается у 99,5% всех инфицированных). Чаще отмечается у взрослых. Состояние не проявляется никакими признаками, и человек не знает о своем инфицировании.
Менингококковый назофарингит развивается у 80% заболевших менингококковой инфекцией. Проявляется обычными для воспалительного процесса в носоглотке симптомами: острое начало, першение в горле, заложенность носа, сухой кашель, головная боль. Может повышаться температура в пределах 37,5°С. Общее состояние и самочувствие ребенка страдают мало. При осмотре выявляется покраснение в зеве и отечность слизистой, иногда покраснение конъюнктив, скудное слизисто-гнойное отделяемое из носа. Чаще это состояние расценивается как проявление острого респираторного заболевания. Правильный диагноз ставится только в очаге инфекции при обследовании контактных лиц. Длительность заболевания от 2 до 7 дней; заканчивается выздоровлением. Но в ряде случаев эта форма предшествует последующему развитию генерализованной формы инфекции.
Менингококцемия развивается остро, внезапно. Ее проявления нарастают очень быстро. Родители могут указать точное время начала болезни, а не только дату. Резко с ознобом повышается температура (до 40°С), которая плохо снижается на прием препаратов, обладающих жаропонижающим действием (ибупрофен** и парацетамол**). Отмечается повторяющаяся рвота и выраженная головная боль, жажда. Но основным и наиболее характерным признаком менингококкового сепсиса является сыпь. Проявляется она уже в первые сутки болезни, реже на вторые. Чаще она локализуется на бедрах, голенях, внизу живота, на ягодицах. Распространяется сыпь быстро, буквально «растет на глазах». Появление высыпаний на лице свидетельствует о тяжести процесса. Это неблагоприятный прогностический признак. Размер сыпи может быть разным: от мелкоточечных кровоизлияний до крупных неправильной («звездчатой») формы элементов багрово-синюшного цвета. Сыпь является кровоизлиянием в кожу, она не исчезает при надавливании, располагается на бледном фоне кожных покровов. Мелкоточечные высыпания держатся 3-4 дня, пигментируются и исчезают. В центре крупных элементов сыпи может развиваться некроз (омертвение) ткани. Некротическая поверхность покрывается коркой, после ее отхождения образуются язвы, которые рубцуются очень медленно (до 3 недель и более). Некроз может возникнуть и на кончике носа, фалангах пальцев, ушных раковинах с развитием сухой гангрены. Клинические симптомы при менингококцемии могут нарастать очень бурно, особенно при молниеносном варианте течения заболевания. Кровоизлияние в конъюнктивы или склеры глаз может появиться даже раньше, чем сыпь на коже. Возможно возникновение и других проявлений геморрагического синдрома: кровотечения (носовое, желудочное, почечное) и кровоизлияния в различных органах. Вследствие нарушения кровоснабжения и обменных процессов за счет токсикоза, при менингококцемии у детей имеются симптомы поражения почек, сердечно-сосудистой системы, легких, глаз, печени, суставов. Поражение суставов характеризуется возникновением боли в крупных суставах и отечности их, ограничением объема движений. В случае кровоизлияния в надпочечники развивается острая надпочечниковая недостаточность за счет дефицита гормонов, которая может послужить причиной смертельного исхода. Такое осложнение также, как и острая почечная недостаточность, возможно при молниеносной форме менингококцемии (сверхостром сепсисе). При отсутствии квалифицированной помощи, смерть может наступить даже за несколько часов.
Гнойный менингококковый менингит также характеризуется острым началом. Появляется резкая разлитая головная боль, маленькие дети реагируют на нее появлением беспокойства, пронзительным плачем. Температура с ознобом может повышаться до 40°С и не снижается после принятия ребенком препаратов с жаропонижающим действием (ибупрофен**, парацетамол**). Головная боль усиливается в ответ на любой раздражитель: громкий звук, свет, даже на прикосновение: у маленьких детей это проявляется в виде симптома «отталкивания материнских рук». Усиление головной боли отмечается при малейшем движении, при повороте головы. Аппетит отсутствует. Многократно повторяющаяся рвота не приносит облегчения. Она не связана с приемом пищи. Может появиться и понос, особенно в раннем возрасте. Ребенок бледный, вялый, пульс учащен, кровяное давление снижено. Мышечный тонус повышен. Характерна поза ребенка в постели: лежа на боку, «свернувшись калачиком», с притянутыми к животу ногами и запрокинутой назад головой. У маленьких детей отмечается выбухание, напряжение и пульсация большого родничка. Иногда появляется расхождение швов между костями черепа. При обезвоживании маленького ребенка за счет рвоты и жидкого стула родничок западает. При распространении процесса на вещество мозга развивается менингоэнцефалит, что проявляется такими симптомами, как нарушение сознания, психические расстройства, двигательное возбуждение и судороги. При осмотре врач выявляет очаговую симптоматику: парезы (или параличи), патологические изменения со стороны черепно-мозговых нервов (глазодвигательные расстройства, снижение слуха и зрения). В тяжелых случаях при возникновении отека мозга возможно нарушение глотания, речи, сердечной деятельности и дыхания.
При смешанной форме могут преобладать как клинические проявления менингита, так и симптомы менингококцемии. В процессе течения генерализованной формы заболевания могут развиваться и редкие формы: поражение суставов, сердца, сетчатки глаз и легких. Но если менингококк попадает с воздухом сразу в легкие, то менингококковая пневмония может развиваться и первично.
Все больные с менингококковой инфекцией или с подозрением на нее в обязательном порядке немедленно госпитализируются в специализированном отделении. Терапия тяжелых форм происходит в реанимационном отделении или палатах интенсивной терапии. В домашних условиях возможно лечение только носителей менингококка и больных менингококковым назофарингитом (при отсутствии в семье других детей в дошкольном возрасте).
В профилактике менингококковой инфекции большое значение имеет изоляция больного ребенка и бактерионосителя.
За контактными детьми обязательно проводится клиническое наблюдение, при этом осматриваются носоглотка, кожные покровы, измеряется температура тела в течение 10 дней. Также всем контактным независимо от возраста и состояния здоровья проводится химиопрофилактика антибактериальными препаратами.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Шкала для оценки органной недостаточности, связанной с сепсисом
Название на русском языке: Шкала для оценки органной недостаточности, связанной с сепсисом
Оригинальное название (если есть): Sequential Organ Failure Assessment Scale (SOFА)
Источник (официальный сайт разработчиков, публикация с валидацией): Vincent JL et al Use of the SOFA score to assess the incidence of organ dysfunction/failure in intensive care units: results of a multicenter, prospective study. Working group on «sepsis-related problems» of the European Society of Intensive Care Medicine. Crit Care Med. 1998 Nov;26(11):1793-800. doi: 10.1097/00003246-199811000-00016. PMID: 9824069.
Тип(подчеркнуть): шкала оценки
Назначение: оценка органной недостаточности, риска смертности и сепсиса у пациентов в отделении интенсивной терапии и реанимации.
Примечание: УНС^ — угнетение нервной системы
Интерпретация: Минимальное значение SOFA = 0; Максимальное значение SOFA = 24; Чем больше баллов у отдельного органа (системы), тем более выражена его дисфункция. Чем больше общее число баллов, тем выше степень полиорганной недостаточности
Оценка возможности гибели пациента = 1ч (1+ exp [7,64 — 0,30хPELOD])
Приложение Г2. Формализованная оценочная система органной дисфункции в педиатрии
Название на русском языке: Формализованная оценочная система органной дисфункции в педиатрии
Оригинальное название (если есть): Pediatric Logistic Organ Dysfunction score
Источник (официальный сайт разработчиков, публикация с валидацией): Leteurtre, S , Martinot, A, Duhamel, A. (2006). Validation of the paediatric logistic organ dysfunction (PELOD) score: Prospective, observational, multicentre study. The Lancet. 367. 902-902. 10.1016/S0140-6736(06)68379-7.
Назначение: Логистическая система оценки органной дисфукции в педиатрии с оценкой риска гибели пациента
Ключ (интерпретация): Оценка возможности гибели пациента = 1ч (1+ exp [7,64 — 0,30хPELOD])
Приложение Г3. Клиническая шкала оценки уровня сознания у больных старше 4-х лет
Название на русском языке: Шкала комы Глазго
Оригинальное название (если есть): the Glasgow Coma Scale, GCS —
Назначение: шкала для оценки глубины комы у взрослых и детей старше 4-х лет; состоит из трёх тестов, оценивающих реакцию открывания глаз, речевые и двигательные реакции. За каждый тест начисляется определённое количество баллов.
Содержание (шаблон):
Ключ (интерпретация):
Приложение Г4. Модифицированная шкала комы Глазго для оценки уровня сознания младенцев и детей
Название на русском языке: Модифицированная шкала комы Глазго для оценки уровня сознания младенцев и детей
Оригинальное название (если есть): Modified Glasgow Coma Scale for Infants and Children
Источник (официальный сайт разработчиков, публикация с валидацией): Morray JP, Tyler DC, Jones TK, Stuntz JT, Lemire RJ. Coma scale for use in brain-injured children. Crit Care Med. 1984 12(12):1018-20.
Назначение: шкала для оценки глубины комы у детей до 4-х лет жизни
Содержание (шаблон)
Ключ (интерпретация):

Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Дата публикации 7 ноября 2017Обновлено 8 декабря 2022
Определение болезни. Причины заболевания
Инфекционный менингит (Viral meningitis) — сборная группа острых, подострых и хронических инфекционных заболеваний, вызываемых различными видами патогенных микроорганизмов (вирусами, бактериями, грибками, простейшими), которые в условиях специфической резистентности организма вызывают поражение оболочек головного и спинного мозга, проявляющееся в выраженном синдроме раздражения мозговых оболочек, тяжёлым интоксикационным синдромом и всегда протекающее с потенциальной угрозой жизни больного.
Причины возникновения
Инфекционный менингит может представлять собой как первичную патологию (развивающуюся как самостоятельная нозологическая форма), так и вторичную (развивающуюся как осложнение другого заболевания). Причина инфекционного менингита — патогенные микроорганизмы, которые в условиях специфической резистентности организма вызывают поражение оболочек головного и спинного мозга.
Неинфекционные причины менингита:
- аутоиммунное воспаление (системная красная волчанка, ревматоидный артрит);
- применение нестероидных противовоспалительных средств (НПВС) и антибиотиков;
- разрыв кист головного мозга;
- онкология;
- травмы головного и спинного мозга;
- операции на мозге.
Пути заражения
Хочется ответить на популярный вопрос читателей и пользователей сети: каков риск заражения от больного, и можно ли находиться рядом с больным без особого риска развития менингита? Ответ достаточно прост: в виду того, что менингит — это сборная группа заболеваний, вызываемая различными инфекционными агентами, то и риск заражения будет зависеть от этиологии менингита, а вот вероятность развития именно менингита — от способностей иммунной системы человека. Другими словами, чтобы знать, есть ли риск, нужно знать, какой именно микроорганизм вызвал менингит у больного и каковы защитные иммунные способности окружающих.
В зависимости от вида менингита различаются пути заражения и механизмы возникновения заболевания. Применительно к инфекционным менингитам можно указать на чрезвычайно широкое географическое распространение, со склонностью к увеличению очагов заболевания на Африканском континенте (менингококковый менингит), более частым развитием болезни у детей и повышению заболеваемости в холодное время года (вирусные менингиты как осложнение ОРВИ). Передача инфекции чаще происходит воздушно-капельным путём [3][5][6].
Факторы риска
К группам риска относятся:
- дети в возрасте до одного месяца, повышенный риск сохраняется до пяти лет;
- члены коллективов с высокой плотностью сотрудников;
- пациенты, которым проводились манипуляции на мозге;
- медицинские работники, особенно микробиологи;
- путешественники;
- люди с иммунодефицитом.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы менингита
Клиническая картина менингита
Достаточно характерными при менингите (и в частности при менингококковом процессе) являются признаки вовлечения в патологический процесс мозговых оболочек (менингеальные синдромы).
Все признаки менингита можно разделить на группы:
- явления гиперестезии (усиления) чувствительности органов чувств — усиление болей при ярком свете (фотофобия), громких звуках (гиперакузия);
- синдром интоксикации — слабость, апатия, упадок сил, ломота в теле, отсутствие аппетита, тошнота и рвота;
- краниофасциальные болевые феномены — с. Бехтерева (боль при перкуссии по скуловой дуге), с. Менделя (боль при давлении на наружный слуховой проход) и др.;
- тонические напряжения — тугоподвижность затылочных мышц, т.е. невозможность приведения головы больного к груди, поза «легавой собаки» (запрокинутая назад голова, подтянутые к животу руки и ноги), с. Кернига (затруднение разгибания ног после выполнения их сгибания в коленных и тазобедренных сочленениях и т.д.);
- патологическое нарушение брюшных и сухожильных рефлексов (как правило, резкое снижение) [4].
Отдельно заслуживает упоминания специфическое проявление, имеющее сходство с симптомами менингита, но не являющееся таковым и не имеющее ничего общего с патогенезом истинного менингита — менингизм, или менингиальный синдром. Чаще всего он развивается вследствие механического или интоксикационного воздействия на мозговые оболочки при отсутствии воспалительного процесса. Купируется при снятии провоцирующего воздействия, в некоторых случаях дифференциальная диагностика возможна лишь при проведении специальных исследований [3].
Симптомы менингита у детей
Менингит у детей развивается чаще и протекает тяжелее, чем у взрослых. Иногда при болезни дети в бессознательном состоянии обхватывают голову и кричат. Такой крик называется гидроцефалическим, он вызван резким повышением внутричерепного давления.
Патогенез менингита
Многообразие возбудителей и индивидуальные особенности индивидуумов в человеческой популяции определяют и достаточно выраженную изменчивость форм и проявлений менингитов, риск заражения для других людей, поэтому в данной статье мы остановимся на наиболее значимых формах заболеваний и их возбудителей в социальном плане.
Менингококковый менингит — всегда острое (острейшее) заболевание. Вызывается менингококком Вексельбаума (грамотрицательная бактерия, неустойчивая в окружающей среде, при температуре 50 градусов Цельсия погибает по истечении 5 минут, УФО и 70% спирт убивают практически мгновенно). Источником распространения инфекции оказывается больной человек (в т.ч. менингококковым назофарингитом) и бактерионоситель, передача происходит воздушно-капельным путём.
Местом внедрения (воротами) является слизистая оболочка носоглотки. В подавляющем числе случаев инфекционный процесс не развивается или развиваются местные формы заболевания. При преодолении менингококком локальных противоинфекционных барьеров происходит гематогенное распространение инфекции и возникает генерализованная менингококковая инфекция, включающая в себя развитие менингококкового менингита, при отсутствии адекватного лечения заканчивающегося в более 50% случаев летальным исходом. В патогенезе заболевания играют роль токсины, освобождающиеся после гибели бактерии в кровяном русле, повреждение стенок сосудов, что ведёт к нарушению гемодинамики, кровоизлияниям в органах и глубоким метаболическим нарушениям. Происходит гиперраздражение оболочек мозга, развитие гнойного воспаления ткани и быстрый рост внутричерепного давления. Зачастую вследствие отека и набухания ткани головного мозга происходит вклинение мозга в большое затылочное отверстие и гибель больного от паралича дыхания.
Скрытый период болезни от 2 до 10 дней. Начало острое (даже правильнее — острейшее). В первые часы заболевания возникает резкое нарастающее повышение температуры тела до 38,5 градусов и выше, выраженная вялость, разбитость, боль в периорбитальной области, снижение аппетита, резкая головная боль. Характерным признаком головной боли является постоянное нарастание её интенсивности, боль диффузная без четкой локализации, распирающего или давящего характера, вызывающая истинное мучение для больного. На высоте головной боли фонтанирует рвота без предшествующей тошноты, не приносящая никакого облегчения. Иногда у больных при тяжёлом неконтролируемом течении, преимущественно у детей в бессознательном состоянии, наблюдается неконтролируемый крик, сопровождающийся обхватыванием головы руками — т.н. «гидроцефалический крик», вызванный резким ростом внутричерепного давления. Врезается в память внешний вид больных — заострение черт лица (симптом Лафора), менингеальная поза на 2-3 сутки заболевания (пока «легавой собаки»). У части больных развиваются геморрагические высыпания на теле, напоминающие звездчатую сыпь (является неблагоприятным признаком). В продолжении 2-3 суток выраженность симптомов нарастает, могут появляться галлюцинации, бред. Степень нарушения сознания может варьироваться от сомноленции до комы, при отсутствии лечения смерть может наступить в любой период.
Туберкулезный менингит — медленно развивающаяся патология. В основном является вторичным, развиваясь при уже имеющемся туберкулезном процессе других органов. Имеет несколько периодов развития, последовательно развивающихся в течении длительного времени:
1. продромальный (до 10 дней, характеризуется неярко-выраженными симптомами общего недомогания)
2. сенсомоторного раздражения (с 8 по 15 день, появление начальных общемозговых и слабых менингеальных проявлений)
3. парезов и параличей (обращает на себя внимание с 3 недели от дебюта инфекционного процесса в виде изменения и потери сознания, расстройства глотания, речи).
Вначале появляется умеренное поднятие температуры тела без выраженных скачков и подъёмов, вполне терпимые головные боли низкой интенсивности, хорошо купирующиеся приёмом анальгетиков. В дальнейшем головные боли усиливаются, подключаются тошнота и рвота. Неизменный признак туберкулезного менингита — поднятие температуры, лихорадка, причем цифры и продолжительность могут варьировать от субфебрильных до гектических значений. Постепенно с конца второй недели появляются и медленно нарастают симптомы дезориентации, оглушенности, заканчивающиеся глубокой «загруженностью» больного, сопором и комой. Развиваются нарушения функции тазовых органов, боли в животе. Так же постепенно развиваются менингеальные симптомы, причём истинно классическая симптоматика (поза «легавой собаки») развиваются лишь в запущенных случаях.
Герпетический менингит чаще всего вызван вирусами простого герпеса 1 и 2 типов, вирусом ветряной оспы и развивается на фоне ослабления организма при ОРВИ или серьёзной иммуносупрессии, в т.ч. СПИДе. Делится на первичный (когда процесс развивается при первичном заражении вирусом) и вторичный (реактивация инфекции на фоне снижения иммунитета). Всегда острое заболевание, первичные проявления зависят от предшествующего преморбидного фона. Чаще на имеющемся фоне явлений ОРВИ, герпетических высыпаний периоральной области и половых органов возникает тяжёлая головная боль диффузного характера, усиливающаяся с течением времени, рвота, не приносящая облегчения. Всё это может протекать на фоне умеренного или высокого повышения температуры тела, неярко выраженных менингеальных симптомов. Нередко присоединяется поражение головного мозга, в таких случаях на 3-4 сутки возникают расстройства психики (часто агрессия), галлюцинации, дезориентация, генерализованные судороги. При должном лечении прогноз обычно достаточно благоприятный, при отсутствии адекватного лечения в условиях нарушенной иммунологической резистентности возможен летальный исход или стойкие резидуальные явления [2].
Взаимосвязь с гайморитом. Если не лечить гайморит, то он может вызвать расплавление костей пазух носа. Через них гной попадает в мозговые оболочки, и развивается менингит.
Классификация и стадии развития менингита
Выделяют следующие виды инфекционного менингита:
1. По этиологическому фактору (непосредственный возбудитель)
- вирусный (энтеровирусный, герпесвирусный, вызванный вирусом энцефалита, респираторными вирусами, вирусом эпидемического паротита и др.)
- бактериальный (менингококковый, пневмококковый, вызванный гемофильной палочкой, туберкулёзной микобактерией, листериозный и др.)
- паразитарный (амебный, токсоплазменый, малярийный плазмодий и др.)
- грибковый (грибки рода кандида, криптококки)
- смешанной этиологии
2. По преимущественному течению воспалительного процесса:
- гнойный (менингококковый, пневмококковый, вызванный гемофильной палочкой)
- серозный (вирусные)
3. Варианты течения менингита:
- острый (как вариант — молниеносный)
- подострый
- хронический
4. По локализации, степени тяжести, клиническим формам и др. [4]
Осложнения менингита
Чем опасен менингит
Осложнения, наблюдаемые при менингите менингококковой природы (реже при других формах менингитов), бывают ранние и поздние, связанные как с катастрофой нервной системы, так и других отделов организма.
Основные последствия менингита:
- отёк и набухание головного мозга (в течении короткого времени резко усиливаются интоксикационные проявления, нарастают общемозговые расстройства, появляется временное психомоторное возбуждение, сменяющееся полной потерей сознания, судорогами, угасанием корнеальных рефлексов. Появляется отек лёгких, нарастает одышка, тахикардия, уменьшается выраженность менингеальных синдромов, смерть наступает от паралича центра дыхания);
- инфекционно-токсический шок (чаще при генерализованном поражении — менингококцемия — стремительный рост температуры тела, нарастание геморрагического синдрома с последующим литическим снижением температуры. Усиливаются болевые ощущения в мышцах и суставах, чувство холода, частый нитевидный пульс, холодный липкий пот, одышка с нарастанием острой почечной недостаточности, снижения артериального давления, судорожного синдрома. При отсутствии адекватного лечения приводит к смерти больного;
- острая надпочечниковая недостаточность (с. Уоттерхауза-Фридериксена — резкое падение артериального давления);
- неспецифические органные поражения (миокардит, артриты, эпилепсия, параличи, кровотечения и др.).[4][5][6].
Устранение осложнений менингита
Тяжелые и жизнеугрожающие осложнения менингита лечатся в отделениях реанимации и интенсивной терапии под постоянным наблюдением медицинского персонала [4]. Терапию подбирает врач индивидуально в зависимости от состояния пациента.
Диагностика менингита
Когда следует обратиться к врачу
Обратиться к инфекционисту нужно немедленно при появлении симптомов менингита: ломоты в теле, мышечных и суставных болей, высокой температуры, тошноты, рвоты и головной боли, усиливающейся при ярком свете и громких звуках. Особенно внимательным к своему состоянию следует быть после посещения африканских стран [11].
Подготовка к посещению врача
Чтобы посетить инфекциониста, специальная подготовка не требуется. Наоборот, если есть подозрения на менингит, не стоит затягивать с посещением доктора, в такой ситуации необходимо действовать быстро.
Первичный диагностический поиск включает в себя опрос и осмотр врачом-инфекционистом и неврологом.
Опрос
На приёме врач может задать вопросы:
- какие страны посещал пациент;
- контактировал ли он с инфекционными больными;
- какими болезнями он страдает, переносил ли травмы и операции;
- какие лекарства применяет;
- есть ли температура, какого характера головная боль, где она локализуется;
- когда появились первые симптомы и лечился ли пациент самостоятельно.
Спинномозговаяпункция
При подозрении на возможный менингит проводится ведущее диагностическое исследование — люмбальная пункция. Она подразумевает введение полой иглы в субарахноидальное пространство спинного мозга на уровне поясничного отдела позвоночника. Цель указанного исследования — уточнить вид, свойства и характер изменения спинномозговой жидкости, определение возможных возбудителей и путей лечения данного вида менингита.
В зависимости от этиологического агента, вызывающего менингит, различаются свойства ликвора, приведем их основные виды и характеристики:
1. Бактериальные менингиты (в т.ч. менингококковый менингит):
- ликвор высокого давления (свыше 200 мм водного столба)
- вытекающая жидкость желто-зеленая, вязкая, со значительной клеточно-белковой диссоциацией, вытекает медленно
- высокое содержание клеток (нейтрофильный плеоцитоз 1000 в мкл и выше)
- поднятие уровня белка 2-6 г/л и выше
- падение уровня хлоридов и сахаров
2. Серозные менингиты (в т.ч. вирусные):
- давление ликвора в норме или слегка увеличенное
- ликвор прозрачный, истекание при проколе 60-90 капель в минуту
- количество клеточных элементов в ликворе (цитоз) менее 800 в мкл
- концентрация белка до 1 г/л и ниже
- глюкоза в пределах нормальных значений
3. Туберкулёзный менингит:
- умеренное повышение ликворологического давления
- прозрачный на вид, иногда опалесцирующая плёнка
- умеренное количество клеток (до 200 в мкл, преимущественно лимфоциты)
- белок повышен до 8 г/л
- глюкоза и хлориды снижены
Лабораторные анализы
Помимо определения физико-химических свойств ликвора, сегодня широко используются методы, позволяющие выделить и установить возбудителя заболевания, что может играть решающую роль в терапии и прогнозе. Наиболее значимыми являются культивирование нативного ликвора на питательные среды (поиск бактериальных, грибковых возбудителей), проведение ПЦР ликвора (полимеразно-цепной реакции) с целью выявления нуклеиновых кислот возбудителя, проведение ИФА (иммуноферментного анализа) ликвора, крови, мочи и т. п. с целью определения антигенов и антител возможных возбудителей менингита, микроскопия ликвора и носоглоточной слизи, клинический и биохимические анализы крови.
Магнитно-резонансная томография (МРТ) и компьютерная томография (КТ)
МРТ головного мозга при менингите достаточно информативно [1][2][4].
КТ для диагностики менингита в большинстве случаев не применяется.
Неврологическое обследование
При менингите обязательно потребуется неврологическое обследование. Оно поможет выявить характерные признаки, например:
- ригидность затылочных мышц — повышенный тонус и сопротивление мышц при попытке движений;
- симптом Кернига — затруднённое разгибание ног;
- симптом Лессажа — поднятый под мышки заболевший ребёнок поджимает ноги к животу и запрокидывает голову.
Лечение менингита
Основным и главным условием эффективной помощи больным менингитом является ранняя госпитализация в стационар и начало специфической этиотропной и патогенетической терапии! Поэтому при малейшем подозрении врача или фельдшера на менингит должны быть предприняты все возможные шаги для скорейшей доставки подозрительного больного в стационар инфекционного профиля и начала лечения, сомнения медицинских специалистов или самого больного в плане диагноза и госпитализации должны расцениваться как необоснованные (опасные) и незамедлительно пресекаться.
Устранение причины менингита
Этиотропная терапия (направленная на избавление от возбудителя) зависит от конкретной ситуации (проведенных исследований, опыта врача, алгоритмов) и может включать в себя назначения антибактериальных препаратов, в т. ч. противотуберкулезных (при менингитах бактериальной, туберкулезной природы, неясности ситуации), противовирусных средств (при герпетическом менингите, других вирусных возбудителях), противогрибковых средств (при грибковых поражениях). Преимущество отдаётся внутривенному введению лекарственных препаратов под контролем состояния больного и периодическим контролем ликвора (контрольная люмбальная пункция). [9]
Симптоматическое лечение
Патогенетическая и симптоматическая терапия направлена на прерывание звеньев патогенеза, улучшение действия этиотропных средств и улучшение общего состояния больного. Она может включать в себя применение гормонов, диуретиков, антиоксидантов, сосудистых средств, глюкозы и т. п. [8]
Противосудорожная терапия
При развитии судорожного синдрома применяется противосудорожная терапия. Её проводят в отделении реанимации и интенсивной терапии (ОРИТ).
Химиопрофилактика
Членам семьи больного, проживающим вместе с ним, для профилактики назначают лечение антибиотиками. Предпочтительным препаратом является ципрофлоксацин, альтернативным — цефтриаксон [12].
Домашнее лечение: что можно и что нельзя делать
Самолечение при менингите недопустимо. При появлении симптомов заболевания нужно немедленно обратиться за медицинской помощью.
Мифы и опасные заблуждения в лечении менингита
- «Менингококковые вакцины могут вызывать менингит или паралич». Заразиться менингитом при вакцинации невозможно — их побочные эффекты редки и включают покраснение или припухлость в месте инъекции, которые длятся до двух дней.
- «Менингит не заразен». Микроорганизмы, вызывающие заболевание, могут передаваться между людьми. Если у пациента выявляют менингококковый менингит, то проживающим вместе с ним обычно назначают антибиотики и иногда для профилактики вакцинируют.
- «Менингококковая инфекция опасна только для маленьких детей». Заболевание чаще всего встречается у детей младше одного года, но заразиться менингококковой инфекцией можно в любом возрасте.
Прогноз. Профилактика
Прогноз при развитии менингита зависит от его возбудителя. При бактериальных менингитах (с учетом того, что в 60% случаев это менингококковый менингит) прогноз всегда (даже в современных условиях стационаров) очень серьёзный — смертность может достигать 10-15%, а при развитии генерализованных форм менингококковой инфекции — до 27% [10]. Даже при благополучном исходе высок риск остаточных (резидуальных) явлений, таких, так нарушения интеллекта, парезы и параличи, ишемический инсульт и др.
Предсказать развитие тех или иных нарушений невозможно, возможно лишь минимизировать их появление своевременным обращением к врачу и началом лечения. При вирусных менингитах прогнозы более благоприятны, в целом летальность составляет не более 1% от всех случаев заболевания.
Профилактика. Вакцинация
Профилактика менингитов включает в себя специфические и неспецифические мероприятия.
Неспецифическая профилактика менингитов: здоровый образ жизни, укрепление иммунитета, соблюдение правил гигиены, использование репеллентов и др.
Специфическая профилактика направлена на разработку иммунитета против некоторых возбудителей инфекционного менингита, это вакцинация, например, от менингококковой инфекции, пневмококка, гемофильной палочки. Наиболее действенны прививки в детских коллективах, т. к. наиболее подвержены развитию менингита дети, и вакцинация достоверно снижает уровень их заболеваемости [4][5].
Диспансерное наблюдение
Сроки диспансерного наблюдения после перенесённого менингита зависят от его вида и тяжести, в среднем они составляют 2–3 года.
Эпидемиологический надзор
Эпидемиологический надзор очень важен для борьбы против менингококкового менингита. Он позволяет:
- обнаружить и подтвердить вспышки заболевания;
- оценить факторы риска, уровень инвалидности и смертности от болезни;
- контролировать развитие, распространение и устойчивость штаммов к антибиотикам;
- оценить эффективность вакцинирования [11].
В России его проводят Роспотребнадзор, центры гигиенического и санитарно-эпидемиологического надзора (ЦГСЭН) и Федеральное медико-биологическое агентство (ФМБА).
Система определения инвалидности
Получение инвалидности возможно при тяжёлом течении менингита, стойкой утрате психических и физических функций и неблагоприятном клиническом и трудовом прогнозе. Инвалидность устанавливает бюро медико-социальной экспертизы после обследования пациента.
- Research article
- Open Access
- Published: 06 September 2019
- Chelsea Perfect2 na1 na2,
- Amanda Rojek1,
- Kajsa-Stina Longuere3,
- Sam Lipworth4,
- Eli Harriss5,
- James Lee1,
- Alex Salam6,
- Gail Carson1,
- Herman Goossens7 &
- …
- Peter Horby1
BMC Medicine
volume 17, Article number: 170 (2019)
Cite this article
-
18k Accesses
-
16 Citations
-
12 Altmetric
-
Metrics details
Abstract
Background
The epidemiology of CNS infections in Europe is dynamic, requiring that clinicians have access to up-to-date clinical management guidelines (CMGs) to aid identification of emerging infections and for improving quality and a degree of standardisation in diagnostic and clinical management practices. This paper presents a systematic review of CMGs for community-acquired CNS infections in Europe.
Methods
A systematic review. Databases were searched from October 2004 to January 2019, supplemented by an electronic survey distributed to 115 clinicians in 33 European countries through the CLIN-Net clinical network of the COMBACTE-Net Innovative Medicines Initiative. Two reviewers screened records for inclusion, extracted data and assessed the quality using the AGREE II tool.
Results
Twenty-six CMGs were identified, 14 addressing bacterial, ten viral and two both bacterial and viral CNS infections. Ten CMGs were rated high quality, 12 medium and four low. Variations were identified in the definition of clinical case definitions, risk groups, recommendations for differential diagnostics and antimicrobial therapy, particularly for paediatric and elderly populations.
Conclusion
We identified variations in the quality and recommendations of CMGs for community-acquired CNS infections in use across Europe. A harmonised European “framework-CMG” with adaptation to local epidemiology and risks may improve access to up-to-date CMGs and the early identification and management of (re-)emerging CNS infections with epidemic potential.
Peer Review reports
Introduction
Endemic, epidemic and emerging infectious diseases, including antimicrobial resistant organisms, remain a serious, cross-border threat to health in Europe. The response to these threats needs to be evidence-based and coordinated, and whilst Europe-wide efforts have been made to link and harmonise public health responses, much less has been done in the clinical sphere. The EU-funded Platform for European Preparedness Against R(e-)emerging Epidemics (PREPARE) was established to promote harmonised clinical research studies on infectious diseases with epidemic potential in order to improve patient outcomes and inform public health responses. One issue identified by PREPARE was the lack of understanding of variations in clinical practice across Europe, which may hamper the interpretation of clinical and surveillance data on emerging infectious threats with epidemic potential and impede the implementation of cross-border clinical research.
Central nervous system (CNS) infections continue to affect populations worldwide with high morbidity, mortality and risk of long-term sequelae and are also associated with a range of emerging and re-emerging viral threats to Europe, such as West Nile virus, Toscana virus, measles and enteroviruses [1, 2]. The epidemiology of community-acquired CNS infections is neither fixed nor homogeneous, with changes over time and between locations. The introduction of vaccines has reduced the burden of the two most common etiological agents for bacterial meningitis in adults and older children, Streptococcus pneumoniae and Neisseria meningitidis [3, 4]. Haemophilus influenzae type B (Hib) is also becoming a rare cause of meningitis in Europe [5]. However, reports of serotype replacement and an increased rate of reduced sensitivity to antimicrobial agents of S. pneumoniae, with varying rates across the region, are a cause of concern, which requires antibiotic regimes to be tailored to regions and travel [3, 5]. Neonatal meningitis is associated with high morbidity and higher incidence compared to older age groups [6]. In neonates, common pathophysiology are primary bloodstream infections with secondary haematogenous distribution to the CNS [6] most commonly caused by Streptococcus agalactiae (group B streptococcus; GBS) or Escherichia coli [3]. Encephalitis, an inflammation of the brain parenchyma associated with high morbidity and risk of long-term sequelae, is commonly caused by viruses [7]. It is estimated that 40 to 60% of cases remain without an aetiological diagnosis [8, 9]. This may partly be due to a lack of consensus on clinical case definitions and standardised diagnostic approaches [10]. The most commonly diagnosed causes of viral CNS infections in Europe are Herpes simplex virus (HSVs), enteroviruses, Varicella-zoster virus (VZV) and arthropod-borne viruses (arboviruses) [11]. The epidemiology of encephalitis is constantly evolving [11], and emerging infectious diseases may present as undifferentiated CNS infections [12]. This is ilustrated by the re-emergence of West Nile virus (WNV) in south-eastern Europe and the emergence of Toscana virus as a leading cause of aseptic meningitis in regions in southern Europe during the summer [13, 14]. Another cause of concern are recent outbreaks of enterovirus-associated severe neurological disease which cause a strain on paediatric intensive care units [15].
Clinical case definitions and clinical management guidelines (CMGs) are important tools for identifying emerging infectious diseases, informing diagnostic and clinical management and providing a degree of standardisation in clinical management practices. In addition, harmonisation of diagnostic and clinical management practices can inform public health outbreak responses and facilitate the design and interpretation of multi-country research, which is a necessity for adequately powered studies of comparatively rare diseases such as CNS infections.
The aim of this review is to identify variations in practices which might be a barrier to the early identification and characterisation of emerging CNS infections with epidemic potential and the implementation of cross-border clinical research as well as public health responses. This is, to our knowledge, the first systematic review and quality appraisal of European CMGs for viral and bacterial CNS infections.
Methods
The systematic review was completed based on a protocol registered in the PROSPERO International prospective register of systematic reviews (ID: CRD42014014212). The protocol was informed by infectious disease specialists and systematic reviewers.
Search strategy
One reviewer conducted the first electronic database search (PubMed, National Guideline Learning Centre, International Guideline Library, TRIP Database) from October 2004 to October 2014. Search terms were as follows: (central nervous system infection [MeSH Terms]) AND (clinical guideline OR clinical practice guideline OR physician guideline OR bedside clinical guideline OR clinical management guideline OR clinical practice protocol OR physician protocol OR clinical management protocol) AND (“last 10 years” [PDat]). An information specialist performed a second updated electronic search of Ovid MEDLINE, Ovid Embase, PubMed, TRIP Database and Google using the exploded thesaurus term “exp Central Nervous System Infections/”, and the free text terms meningitis, encephalitis, meningoencephalitis, combined with a search filter for guidelines to 22 June 2017.
Search terms:
(“Central Nervous System Infections”[Mesh]) OR meningitis [Title/Abstract]) OR meningoencephalitis [Title/Abstract]) OR encephalitis [Title/Abstract])) AND (guideline [Title]) OR guidelines [Title]) OR guidance [Title]) OR protocol [Title]) OR protocols [Title]) OR ((“Guideline” [Publication Type] OR “Guidelines as Topic”[Mesh]) OR “Practice Guideline” [Publication Type])).
TRIP Database and Google were also searched for “meningitis guideline*”, “encephalitis guideline*” and “meningoencephalitis guideline*” up to 31 January 2019. The electronic database searches were supplemented by searching the references of included CMGs and CMGs identified through a brief electronic survey which was e-mailed to 115 clinicians in 33 European countries, through the CLIN-Net clinical network of the COMBACTE-Net Innovative Medicines Initiative [16, 17]. The survey asked clinicians which CMGs they used in their daily practice to identify and manage patients presenting with syndromes of acute, community-acquired CNS infections, and asked them to submit the CMGs via hyperlink or by e-mail. The survey was open from 20 June to 30 December 2016, with two electronic reminders.
Eligibility criteria
Two reviewers screened the title, abstract and full-text guidelines for inclusion. CMGs covering diagnostics and/or clinical management of suspected community-acquired bacterial or viral CNS infections which were aimed at or used by clinicians in Europe and published from 2004 onwards were included. The CMG produced by Médicins Sans Frontières (MSF) aimed at field settings globally was included, as it could be used in Europe in emergency situations. There were no language limitations. Guidelines published in non-English languages were translated using Google Translate and reviewed by a reviewer with good to excellent knowledge of the language. Guidelines that were not aimed at European populations were excluded, unless a clinician responding to the survey reported using them. General antibiotic and local standard operating policies were excluded. Guidelines focused only on patients with specific risk factors, such as HIV, were excluded.
Data extraction
A standardised form for data extraction covering case definitions, diagnostic methods, differential diagnostics and medical management recommendations was developed. One reviewer extracted data from the CMGs and a second reviewer checked the data.
Quality appraisal
The CMGs were critically appraised by two reviewers independently using the Appraisal of Guidelines for Research and Evaluation II (AGREE II) Instrument [18, 19]. The quality was assessed independently by each reviewer for six domains: (1) scope and purpose, (2) stakeholder involvement, (3) rigour of development, (4) clarity of presentation, (5) applicability and (6) editorial independence, and through an overall quality score. Efforts were made to find additional information online on associated webpages for CMGs with limited information about the methodology used. Within each domain, there were a number of sub-criteria to score from 1 to 7 (Additional file 1). A score of one was assigned if there was no information or the criteria was not met; a score of seven when the criteria were met. These scores were summarised for each domain, and the total score for the domain calculated as the percentage of the total possible score for that domain. The final score for each domain was calculated as the average of the reviewers’ scores. Each CMG was also given a total overall quality assessment score based on the average score for all the domains (7 being the highest quality) together with a recommendation for use with or without further modifications.
Results
Clinical management guidelines
A total of 26 CMGs covering community-acquired suspected bacterial or viral CNS infections met the inclusion criteria for the review (Fig. 1). The 26 CMGs were produced in Denmark (n = 2), France (n = 2), Germany (n = 2), Ireland (n = 1), the Netherlands (n = 1), Norway (n = 1), Scotland (n = 1), Spain (n = 3), the UK (n = 6), Europe (n = 3), the USA (n = 3) and MSF (n = 1) (Fig. 2). Ten focused on viral encephalitis/meningoencephalitis, 14 on bacterial meningitis and two on both (Additional file 2).
PRISMA flowchart
Full size image
Survey response and national CMG coverage
Full size image
Of the 76 clinicians (n = 76/115, 66%) from 30 European countries who responded to the survey, 29% reported using CMGs produced by US-based, 27% by national, 23% by local and 14% by European organisations. There were no national CMGs identified from those countries where respondents reported using international CMGs.
Quality appraisal
The overall quality of the CMGs ranged from three to seven (Table 1). Ten CMGs were assessed as of high quality (scores 6–7), 12 of medium (scores 4–5) and four of low quality (score ≤ 3). Six CMGs which focused on bacterial CNS infections gained the maximum quality score. Three CMGs scored below 4 and were assessed as in need of modifications in order to adhere to the AGREE II guideline development standards [19]. These modifications included additional information such as the methodology used to identify evidence and formulate recommendations, explicit links between evidence and recommendations and information about stakeholder engagement and peer review. Wide variations in scores between CMGs were seen for “rigour of development”. Seven CMGs scored above 75% for this domain, six of which covered bacterial [2, 5, 20,21,22,23,24], and one viral [22] CNS infections. Most CMGs scored well on “clarity of presentation” and “scope and purpose”. Some score variations may be due to a lack of information presented, such as on stakeholder engagement, editorial independence and plans for regular revisions. This may partly explain the general low scores for “applicability” and “editorial independence”.
Full size table
Signs and symptoms at presentation
Viral encephalitis/meningoencephalitis
Encephalitis is an inflammation of the brain parenchyma associated with neurological dysfunction [7, 10], which is reflected in the syndromic presentation. Meningoencephalitis affects both the brain parenchyma and meninges [25]. Four of the 12 CMGs covering viral aetiologies described symptoms at presentation in adults [7, 10, 22, 26], four in paediatric populations [7, 10, 27, 28] and six in unspecified populations [25, 29,30,31,32,33] (Table 2). Most of the guidelines cited focal neurological signs, seizures, fever, altered levels of consciousness (ALOC) and changes to personality or behaviour as signs and symptoms of encephalitis in both children and adults. It was noted that objective fever might be lacking at the time of assessment [10, 26] particularly in immunosuppressed patients [10].
Full size table
Bacterial meningitis
Nine CMGs covering bacterial CNS meningitis presented symptoms at presentation in adults [2, 5, 23, 34,35,36,37,38,39], ten in children [5, 20, 21, 23, 24, 34,35,36, 38, 40], eight in infants [5, 20, 23, 24, 34, 35, 38, 40] and one in unspecified populations [31] (Table 2). The classic symptoms of fever, headache, neck stiffness, followed by altered mental status and petechial rash, were most frequently described for adults and older children. However, for children, there were a wider range of symptoms reported, with some such as leg pain and cold hands and feet specifically described in children. The symptoms in infants and neonates were more general and can be undistinguishable from sepsis [20]. Irritability, fever and poor feeding were most commonly described, followed by bulging fontanelle, petechial rash and lethargy. It was also highlighted by several CMGs that although high fever can be a sign of severity, fever might not always be present [24, 34], particularly in neonates [5, 23, 24, 40]. This is consistent with the conclusions in the recent CMG by the European Society for Microbiology and Infectious Diseases (ESCMID) that, based on evidence reviews, there are no clinical signs and symptoms that are present in all children [5]. It was also highlighted that the classic signs of meningitis are not always present in adults either [23]. Therefore, bacterial meningitis cannot be ruled out based on the absence of classical signs and symptoms alone [5].
Diagnostic methods
Viral encephalitis/meningoencephalitis
Encephalitis is generally diagnosed based on a combination of clinical, laboratory and neuroimaging features [10, 22]. Cerebrospinal fluid (CSF) investigation with polymerase chain reaction (PCR) can differentiate common aetiologies [41,42,43]. Epidemiological factors can guide further investigations [22]. Most CMGs recommended urgent blood and CSF sampling, unless lumbar puncture (LP) is contraindicated due to signs of raised intracranial pressure (ICP) (Table 3). Magnetic resonance imaging (MRI) was also recommended when possible, or alternatively computed tomography (CT), since MRI can be useful to detect early changes and for excluding alternative causes and is more sensitive and specific compared to CT [10]. It was highlighted that although some specific changes on MRI have been associated with certain aetiological agents (e.g. HSV and arboviruses), it does not always assist in differentiation and findings might initially be normal [7]. EEG to aid diagnostics was mainly recommended for patients displaying certain symptoms such as altered behaviour or non-convulsive seizures, to exclude non-infectious causes [22].
Full size table
Bacterial meningitis
All CMGs covering bacterial CNS infections recommended urgent LP and most recommended blood sampling (Table 3), since a positive CSF culture is confirmative of bacterial meningitis and enables in vitro testing of antimicrobial susceptibility to optimise antibiotic treatment, and urgent LP increases diagnostic chances [5]. If CSF examination is not possible, serum markers of inflammation and blood cultures, especially if taken prior to antibiotics, can support the diagnosis and immunochromatographic antigen testing and PCR can provide additional information [5]. The CMG by MSF did not recommend LP for new cases in an epidemic context when a meningococcal aetiology was confirmed [38]. Sixty-nine percent (n = 11/16) recommended a CT scan before LP if clinical signs of raised ICP [2, 5, 23, 31, 34,35,36,37, 39, 40, 44]. In contrast, the CMG by NICE stated that CT is unreliable for identifying raised ICP and recommended clinical assessment instead of CT [24].
Differential diagnostics
Viral encephalitis/meningoencephalitis
There were wide variations in the differential diagnostic recommendations for suspected viral CNS infections, reflecting the many potential causative agents (Table 4). All CMGs recommended testing for HSV and VZV and most also for enteroviruses and human immunodeficiency virus (HIV). Fifty percent recommended testing for parechoviruses [10, 22, 25, 28, 30, 31], with one CMG specifying only in children [31] and three only in children under 3 years old [10, 25, 30]. Other CMGs recommended testing for Epstein-Barr virus (EBV), human herpesvirus [6, 7], adenoviruses and, depending on season or exposure, arboviruses. Testing for influenza, mumps, measles and rubella were also recommended, especially during an on-going epidemic [30]. Many, but not all CMGs provided differential diagnostic tables based on risk factors, such as age, immune status, travel, animal contact and seasonality [7, 10, 22, 25, 27,28,29]. It was noted by some that PCR, e.g. for HSV, the most commonly diagnosed aetiological agent, can be falsely negative, especially in children and early disease course [10]. If a test is negative and still concerns about the diagnosis, it was recommended to take a second CSF sample within 3 to 7 days [7, 10, 22]; one CMG specified a minimum of 4 days after onset of neurological symptoms [26].
Full size table
Bacterial meningitis
There was consensus on the initial differential diagnostics for adults and older children presenting with syndromes suggestive of bacterial meningitis (Table 5). Besides two CMGs which only focused on N. meningitidis [20, 21], all recommended testing for N. meningitidis and S. pneumoniae in adults and children, but with variations in recommendations for Hib testing. Most also recommended testing for L. monocytogenes in adults; four specified for adults over 50 years [5, 31, 39, 44], and one in adults over 60 years [2]. Additional risk groups for L. monocytogenes were specified as adults over 18 years old with chronic conditions causing immunosuppression [2, 5, 25, 36, 39].
Full size table
The different epidemiology for neonatal meningitis was reflected in the eight CMGs providing recommendations for neonates. All recommended testing for GBS, most also for E. coli (n = 7) and L. monocytogenes (n = 7). There were variations in the definitions of risk groups for neonates and infants. The CMG produced by MSF recommended testing for GBS and Gram-negative bacteria up to 7 days of age and S. pneumoniae and L. monocytogenes in more than 7-day-old neonates [38]. Two CMGs recommended using the neonate recommendations in infants up to 3 months of age [24, 38]. For infants beyond the neonatal period, most recommended testing for N. meningitidis (n = 11), S. pneumoniae (n = 10) and Hib (n = 6), again with variations in the age cut-offs.
Empirical treatment
Viral encephalitis/meningoencephalitis
Although a wide range of viruses can cause CNS infections, the treatment options are limited. Early treatment using acyclovir (I.V.) pending diagnosis was recommended by the CMGs focused on viral CNS infections that included treatment recommendations [7, 22, 26,27,28,29,30,31,32,33] since early treatment with acyclovir has been associated with a lower risk of sequelae and death from the most commonly diagnosed cause, HSV [7] (Table 6). The recommended dose for adults or unspecified populations was 10 mg/kg I.V. with a recommended duration varying from 10 to more than 14 days. A CMG from France (2017) recommended the addition of amoxicillin in adults to cover for risk of L. monocytogenes [26]. The dose for children ranged from 10 to 20 mg/kg acyclovir I.V. for 14 to more than 21 days [27, 28], to 20 mg/kg I.V. for neonates for at least 14 days [27, 28, 32]. It was noted that treatment and duration should be assessed depending on additional symptoms and modified depending on diagnostic results.
Full size table
Bacterial meningitis
All 15 CMGs covering treatment recommended urgent administration of antibiotics on clinical suspicion of bacterial meningitis (Table 7). Thirty-three percent (n = 5/15) specified a time-frame for administration, ranging from within one [2, 5] to three [34, 36, 37] hours. Forty-seven percent (n = 7/15) recommended pre-hospital antibiotics if the patient initially presents to a healthcare setting outside of a hospital. One CMG noted that there are no prospective clinical data on the relationship of the timing of antimicrobial administration to clinical outcome in patients with bacterial meningitis, but since it is a neurologic emergency, appropriate therapy is recommended as soon as possible after the diagnosis is considered likely [44]. It was highlighted that the choice of antibiotics should be informed by risk factors for different aetiologies, such as age and risk of reduced susceptibility to penicillin and third-generation cephalosporins [5]. This was reflected in the CMGs, though with variations in specification of at-risk groups. Most recommended a third-generation cephalosporin alone [5, 34,35,36, 38, 39, 44] or in combination with a penicillin for all adults [2, 23, 37], “elderly” [36] and over 50 [5, 39, 44] or over 60 years [2], due to higher risk of L. monocytogenes infection in these risk groups [5, 34, 36, 39]. Most guidelines that provided recommendations for neonates recommended a third-generation cephalosporin plus penicillin [5, 20, 23, 24, 35, 38, 40, 44] or alternatively an aminoglycoside with penicillin [5, 35, 38, 44]. However, the age cut-off for these recommendations varied, ranging from 1 [5, 23, 44], to 2 [35], or 3 months of age [20, 24, 38, 40]. For older infants and children, there was consensus on the recommendations of a third-generation cephalosporin alone [5, 19,20,21, 23, 34,35,36, 38]. The guideline by MSF recommended a cephalosporin in an epidemic context where N. meningitides is the most likely pathogen, and addition of cloxacillin if associated skin or umbilical cord infection for all age-groups [38].
Full size table
Many CMGs recommended the addition of vancomycin [2, 5, 34,35,36,37, 39, 40] alternatively rifampicin [2, 5, 37, 39] if there is suspicion of reduced sensitivity to penicillin, except for neonates. However, the CMGs produced by IDSA (USA) and NICE (UK) gave different advice. The first recommended vancomycin to everyone except neonates (< 28 days old) [44], whereas the CMG by NICE recommended vancomycin to all returning travellers or those with recent prolonged or multiple exposure to antibiotics within the past 3 months, to cover risk of penicillin-resistant strains of S. pneumoniae [24].
All CMGs focused on bacterial CNS infections recommended adjunctive corticosteroids therapy before or with first dose of antibiotics. Some recommended it up to a few hours [37], 4 h [5, 39], 12 h [2, 24] or 24 h post-antibiotics [20, 35]. Four explicitly did not recommend steroids for patients with immunosuppression [34] or for neonates [5, 24, 44]. One CMG noted that corticosteroids in infants is controversial and only recommended for Hib meningitis [44]. It was highlighted that corticosteroids can reduce inflammation and brain oedema and has in some studies shown benefits of reducing rates of complications and improving outcomes in patients with meningitis, but also that some studies have raised concerns about potential side effects [2].
Discussion
The data highlights the wide range of CMGs for acute, community-acquired CNS infections in use across Europe and variations in quality, clinical case definitions for guiding identification and in initial clinical recommendations. Most CMGs were produced by national or European organisations. Several survey respondents reported using CMGs produced by other countries in or outside of Europe, which may have implications for timely identification of causative pathogens and use of antibiotics, unless they are adapted to regional epidemiology.
There were several high-quality CMGs that adhered to most of the standards set out in the AGREE II tool. All of the highest scoring CMGs were focused on bacterial aetiologies. Many were more than 3 years old, which is the recommended time-frame for re-assessment of validity [18, 45, 46]. This is a concern in light of the rapidly changing epidemiology of infections and antimicrobial resistance. The most recent Europe-wide CMG on bacterial meningitis was published in 2016 [5], whilst the most recent Europe-wide CMG for viral CNS infections was updated in 2010 [32]. Though there might be additional CMGs not identified through the review or survey, this, together with the fact that many survey respondents used international CMGs, highlights a need for an updated European-wide CMG covering viral CNS infections in adult and paediatric populations that can be adapted nationally.
There was a general consensus on diagnostic methods, but wider variations in infectious disease differential diagnostics recommendations, especially for paediatric and elderly populations. There was also general consensus on the most common bacterial causative agents for adults and older children, but variations in differential diagnostic recommendations for infants, neonates and elderly and in the definitions of these risk groups. This is illustrated by the different risk groups identified for L. monocytogenes infection, which in two CMGs were defined as adults over 50 years [5, 44], whereas over 60 years in another [2]. It is also illustrated by the wide variations in the definition of risk groups for GBS, defined as younger than 1 week [38], 28 days [2, 5, 23, 24, 45], 3 months [34, 40] or 24 months [44] in the recommendations for neonates and infants.
In regard to empirical treatment, there was general consensus on recommended initial therapy for suspected viral aetiologies, pending diagnostics. Moreover, there was a consensus across CMGs on the need for urgent I.V. antibiotics on clinical suspicion of bacterial meningitis. However, only about half recommended pre-hospital antibiotics when presenting outside of a hospital setting. All CMGs recommended a third-generation cephalosporin for suspected bacterial aetiologies, to cover the most common pathogens in adults and children, but with variations in recommendations for adding penicillin to cover L. monocytogenes. Most of the European CMGs recommended the addition of vancomycin or rifampicin if decreased susceptibility to penicillin or third-generation cephalosporin is suspected based on geographical regions visited, whereas the CMG by NICE recommended it to all returning travellers [24]. The CMG by IDSA aimed at all global settings recommended vancomycin to everyone beyond neonatal age [44], which highlights the risk of inappropriate antibiotics usage unless adapted to regional epidemiology.
Some of the variations in recommendations can be explained by regional differences in epidemiology and risks of reduced sensitivity to antimicrobial agents. ECDC data from 2015 shows wide variations in reduced penicillin resistance rates of S. pneumoniae from 0.6% in Belgium, to more than 20% in Slovakia, Bulgaria, France, Spain, Iceland, Poland, Malta and Romania [47]. The variations in recommendations seen between CMGs produced in Europe, compared to those produced outside of Europe, but used by clinicians in Europe, indicate risks of inappropriate differential diagnostic requests and antimicrobial treatment regimes, unless the guidelines are adapted to national settings. This may lead to delayed identification of diseases and inappropriate initial management. The variations seen in recommendations for paediatric and elderly populations and the limited number of CMGs covering these populations also indicate a need to ensure equity in access to CMGs covering all different at-risk population, as well as region-appropriate recommendations.
The review highlights a need for clinicians to ensure that CMGs are robustly developed, up-to-date and appropriate for the setting and population. In an increasingly global world, it is important to ensure CMGs also address risks of travel-imported infections. Some CMGs addressed this by providing tables based on risk factors [7, 10], or links to websites with up-to-date international surveillance data and risk assessments [5], such as the ECDC and the World Health Organizations websites. This highlights the importance of these websites to provide current data about the epidemiology of circulating infections and the risk of antibiotic-resistant strains globally. Other variations reflect limitations in the evidence available, such as the definition of risk groups for infections and effective treatment strategies for these. Furthermore, the limitations in evidence was also reflected in the variations in recommended timing of antibiotics and corticosteroids for bacterial CNS infections, which was also noted in a recent review [3].
This review highlights important differences in quality, coverage and initial clinical recommendations between the CMGs. The AGREE II tool was useful for assessing the quality of the CMGs. It may be used together with other tools, such as the 4-item Global Rating Scale (GRS), but a comparison showed that the GRS is less sensitive in detecting differences in guideline quality [48]. There are limitations to the review, in only including CMGs which were published or accessible via the survey, and despite the lack of language restrictions, most CMGs identified were produced in English or by EU/EEA member states. Furthermore, the data extraction was limited to parameters associated with the early identification and initial management of syndromes of community-acquired CNS infections, to assess variations which could impact on the early identification, management and control of emerging infections with epidemic potential. Antibiotic dosage was not presented, as this is a clinical decision which may be affected by individual patient characteristics. The review does not attempt to create a new guideline, but to highlight important limitations and differences in CMGs in use across Europe, identifying the need to update recommendations and harmonise standards in order to inform future research needs and CMG development.
Despite these limitations, this review highlights variations in quality and recommendations between the CMGs, which may be barriers for the rapid identification and management of CNS infections which may have an impact on health outcomes and timely identification of emerging outbreaks. Considering the resources required to develop complex, evidence-based CMGs, not all health systems might have the resources required. A “framework-CMG” produced by an international network of appropriate experts and stakeholders can provide a useful model for CMG development, as evident by the high-quality CMGs identified, some of which have been adopted by clinicians in several countries. This internationally produced framework CMG would need to address regional risks and consider resources for regular review, updating and dissemination. This model can also improve harmonisation of case definitions and recommendations, which can facilitate equity in access to best available evidence-based recommendations, rapid identification of emerging infections and clinical, research and public health responses to epidemics. The recent guideline on bacterial CNS infections produced by ESCMID [5] is a good example of a robust, comprehensive CMG aimed at a Europe-wide audience, which can serve as a model to be adapted to regional epidemiology as appropriate and monitored for uptake across the region.
Conclusions
This review highlights variations in the quality and recommendations of CMGs for community-acquired CNS infections in use across Europe. A harmonised European framework-CMG with adaptation to local epidemiology and risks may improve access to up-to-date CMGs and the early identification and management of (re-) emerging CNS infections with epidemic potential. The review particularly highlights the need for an updated European CMG for infectious encephalitis, which covers all risk groups, including paediatric and elderly populations. Further research into risk groups for infections and effective treatment strategies to target these populations is required.
Availability of data and materials
All data generated or analysed during this study are included in this published article [and its Additional files].
Abbreviations
- AEPED:
-
Asociación Española de Pediatría
- AGREE II:
-
Appraisal of Guidelines for Research and Evaluation II
- ALOC:
-
Altered level of consciousness
- AMS:
-
Altered mental status
- BIA: ABN:
-
British Infection Association: Association of British Neurologists
- BPAIIG:
-
The British Paediatric Allergy Immunology and Infections Group
- CLIN-Net:
-
Clinical investigator network
- CMG:
-
Clinical management guideline
- CMV:
-
Cytomegalovirus
- CNS:
-
Central nervous system
- COMBACTE-Net:
-
Combatting antibiotic resistance in Europe-network
- CSF:
-
Cerebral spinal fluid
- CT:
-
Computerised tomography
- DGN: BM:
-
Deutsche Gesellschaft für Neurologie: Bakterielle Meningoenzephalitis
- DGN: VM:
-
Deutsche Gesellschaft für Neurologie: Virale Meningoeczephalitis
- DNS:
-
Dansk Neurologisk Selskab
- DSI:
-
Dansk Selskab for Infektionsmedicin
- EBV:
-
Epstein-Barr virus
- ECDC:
-
European Centre for Disease Prevention and Control
- EEA:
-
European Economic Area
- EEG:
-
Electroencephalogram
- EFNS:
-
European Federation of Neurological Societies
- ESCMID:
-
European Society of Clinical Microbiology and Infectious Diseases
- EU:
-
European Union
- GBS:
-
Streptococcus agalactiae; group B streptococcus
- GRS:
-
Global Rating Scale
- HHV:
-
Human herpesvirus
- Hib:
-
Haemophilus influenzae type B
- HIV:
-
Human immunodeficiency virus
- HPSC:
-
Health Protection Surveillance Centre
- HSV:
-
Herpes simplex virus
- ICP:
-
Intracranial pressure
- IDSA:
-
Infectious Diseases Society of America
- IEC:
-
International Encephalitis Consortium
- I.V.:
-
Intravenous
- JEV:
-
Japanese encephalitis virus
- LP:
-
Lumbar puncture
- MeSH:
-
Medical subject headings
- MHSSE:
-
Ministry of Health, Social Services and quality
- MRI:
-
Magnetic resonance imaging
- MSF:
-
Médicins Sans Frontières
- NICE:
-
The National Institute for Health and Care Excellence
- NNF:
-
Norsk Nevrologisk Forening
- NVN:
-
Nederlandse Vereniging voor Neurologie
- PCR:
-
Polymerase chain reaction
- PHE: ME:
-
Public Health England: Meningoencephalitis
- PHE: VE:
-
Public Health England: Viral Encephalitis
- PREPARE:
-
Platform for European Preparedness Against (Re-)emerging Epidemics
- PROSPERO:
-
International Prospective Register of Systematic Reviews
- RSV:
-
Respiratory syncytial virus
- SIGN:
-
Scottish Intercollegiate Guidelines Network
- SPILF:
-
Société de Pathologie Infectieuse de Langue Française
- TBEV:
-
Tick-borne encephalitis virus
- TRIP:
-
Turning research into practice
- UK:
-
United Kingdom
- UKJSS:
-
UK Joint Specialist Societies
- VZV:
-
Varicella-zoster virus
- WNV:
-
West Nile virus
References
-
Sundaram C, Shankar SK, Thong WK, Pardo-villamizar CA. Pathology and diagnosis of central nervous system infections. SAGE-Hindawi Access Res Pathol Res Int. 2011;2011:8782–63.
Google Scholar
-
McGill F, Heyderman RS, Michael BD, Defres S, Beeching NJ, Borrow R, et al. The UK joint specialist societies guideline on the diagnosis and management of acute meningitis and meningococcal sepsis in immunocompetent adults. J Infect. 2016;72(4):405–38.
Article
CASGoogle Scholar
-
van Ettekoven CN, van de Beek D, Brouwer MC. Update on community-acquired bacterial meningitis: guidance and challenges. Clin Microbiol Infect. 2017;23(9):601–6.
Article
Google Scholar
-
McIntyre PB, O’Brien KL, Greenwood B, van de Beek D. Effect of vaccines on bacterial meningitis worldwide. Lancet. 2012;380(9854):1703–11.
Article
Google Scholar
-
van de Beek D, Cabellos C, Dzupova O, Esposito S, Klein M, Kloek AT, et al. ESCMID guideline: diagnosis and treatment of acute bacterial meningitis. Clin Microbiol Infect. 2016;(22):S37-S62. https://doi.org/10.1016/j.cmi.2016.01.007.
Article
Google Scholar
-
Ku LC, Boggess KA, Cohen-Wolkowiez M. Bacterial meningitis in the infant. Clin Perinatol. 2015;42(1):29–45.
Article
Google Scholar
-
Tunkel AR, Glaser CA, Bloch KC, Sejvar JJ, Marra CM, Roos KL, et al. The management of encephalitis: clinical practice guidelines by the Infectious Diseases Society of America. Clin Infect Dis. 2008;47:303–27.
Article
CASGoogle Scholar
-
Glaser CA, Gilliam S, Schnurr D, Forghani B, Honarmand S, Khetsuriani N, et al. In search of encephalitis etiologies: diagnostic challenges in the California encephalitis project, 1998-2000. Clin Infect Dis. 2003;36(6):731–42.
Article
Google Scholar
-
Granerod J, Ambrose HE, Davies NW, Clewley JP, Walsh AL, Morgan D, et al. Causes of encephalitis and differences in their clinical presentations in England: a multicentre, population-based prospective study. Lancet Infect Dis. 2010;10(12):835–44.
Article
Google Scholar
-
Venkatesan A, Tunkel AR, Bloch KC, Lauring AS, Sejvar J, Bitnun A, et al. Case definitions, diagnostic algorithms, and priorities in encephalitis: consensus statement of the international encephalitis consortium. Clin Infect Dis. 2013;57:1114–28.
Article
CASGoogle Scholar
-
Boucher A, Herrmann JL, Morand P, Buzele R, Crabol Y, Stahl JP, et al. Epidemiology of infectious encephalitis causes in 2016. Med Mal Infect. 2017;47(3):221–35.
Article
CASGoogle Scholar
-
Mailles A, Stahl JP, Bloch KC. Update and new insights in encephalitis. Clin Microbiol Infect. 2017;23(9):607–13.
Article
CASGoogle Scholar
-
Charrel RN, Gallian P, Navarro-Marí J-M, Nicoletti L, Papa A, Sánchez-Seco MP, et al. Emergence of Toscana virus in Europe. Emerg Infect Dis. 2005;11(11):1657–63.
Article
CASGoogle Scholar
-
Sigfrid L, Reusken C, Eckerle I, Nussenblatt V, Lipworth S, Messina J, et al. Preparing clinicians for (re-)emerging arbovirus infectious diseases in Europe. Clin Microbiol Infect. 2018;24(3):229–39.
Article
CASGoogle Scholar
-
European Centre for Disease Prevention and Control. Rapid Risk Assessment — Enterovirus detections associated with severe neurological symptoms in children and adults in European countries. Stockholm: ECDC; 2016. [cited 2017 27 Nov]
Google Scholar
-
ND4BB COMBACTE. CLIN-Net the Netherlands2019. Available from: https://www.combacte.com/about/clin-net/. [cited 2019 feb]
-
UMC Utrecht Julius Centre. Research Online Utrecht. the Netherlands; 2019. Available from: http://portal.juliuscentrum.nl/research/en-us/home.aspx. [cited 2019 Feb]
-
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, et al. AGREE II: advancing guideline development, reporting and evaluation in health care. J Clin Epidemiol. 2010;63:1308–11.
Article
Google Scholar
-
AGREE Next Steps Consortium. The AGREE II Instrument [Electronic version] 2009 Available from: http://www.agreetrust.org. [cited 2017 5 Dec]
Google Scholar
-
SIGN. Management of invasive meningococcal disease in children and young people: a national clinical guideline Scotland 2008 [cited 2018 April].
-
Álvarez JCB, Villena AE, Moya JMG-L, Benavent PG, Dios JGd, Hoyos JAGd, et al. Clinical practice guidelines in the Spanish NHS: clinical practice guideline on the management of invasive meningococcal disease 2013 [cited 2018 March].
-
Solomon T, Michael BD, Smith PE, Sanderson F, Davies NWS, Hart IJ, et al. Management of suspected viral encephalitis in adults — Association of British Neurologists and British Infection Association National Guidelines. J Infect. 2012;64:347–73.
Article
CASGoogle Scholar
-
van de Beek D, Brouwer MC, de Gans J, Verstegen MJT, Spanjaard L, Pajkrt D, et al. Richtijn Bacteriële Meningitis 2013 [cited 2018 March].
Google Scholar
-
NICE Clinical Guidelines No. 102. Meningitis (bacterial) and meningococcal septicaemia in under 16s: recognition, Diagnosis and management UK2015 [cited 2019 Feb].
-
PHE. UK standards for microbiology investigations: meningoencephalitis UK: PHE; 2014. Available from: www.gov.uk/government/uploads/system/uploads/attachment_data/file/344105/S_5i1.pdf. [cited 2018 March]
-
Stahl JP, Azouvi P, Bruneel F, Broucker T, Duval X, Fantin B, et al. Guidelines on the management of infectious encephalitis in adults. Med Mal Infect. 2017;47(3):179-94.
Article
CASGoogle Scholar
-
Navarro Gómez M, González F, Santos Sebastián M, Saavedra Lozano J, Hernández Sampelayo Matos T. Encefalitis Spain: AEPED; 2011 [cited 2018 March].
-
Kneen R, Michael BD, Menson E, Mehta B, Easton A, Hemingway C, et al. Management of suspected viral encephalitis in children — Association of British Neurologists and British Paediatric Allergy, Immunology and Infection Group National Guidelines. J Infect. 2012;64:449–77.
Article
CASGoogle Scholar
-
Skovbølling SL, Pleger C. Encephalitis Stratgidokument 2015 [cited 2018 March].
-
PHE. UK Standards for Microbiology Investigations: Investigation of Viral Encephalitis (G4: Investigations of Viral Encephalitis and Meningitis) UK, PHE, 2014 (cited 2018 March).
-
Norsk nevrologisk forening. Veileder I akuttnevrologi Norway2016 [cited 2018 March].
-
Steiner I, Budka H, Chaudhuri A, Koskiniemi M, Sainio K, Salonen O, et al. Viral meningoencephalitis: a review of diagnostic methods and guidelines for management. Eur J Neurol. 2010;17:999–1009.
Article
CASGoogle Scholar
-
Uta-Meyding-Lamadé. Virale Meningoenzephalitis Stuttgart: Deutsche Gesellschaft für Neurologie; 2012 [cited 2018 March].
Google Scholar
-
Guery B, Roblot F, Gauzit R, Varon E, Lina B, Bru P, et al. Practice guidelines for acute bacterial Meningitidis (except newborn and nosocomial meningitidis): short version. Med Mal Infect. 2008;39:356–67.
Google Scholar
-
O’Flanagan D, Bambury N, Butler K, Cafferkey M, Cotter S, McElligott P, et al. Guidelines for the early clinical and public health management of bacterial meningitis (including meningococcal disease) 2015 [cited 2018 March].
Google Scholar
-
Chaudhuri A, Martin PM, Kennedy PGE, Andrew Seaton R, Portegies P, Bojar M, et al. EFNS guideline on the management of community-acquired bacterial meningitis: report of an EFNS task force on acute bacterial meningitis in older children and adults. Eur J Neurol. 2008;15:649–59.
Article
CASGoogle Scholar
-
Pfister H. Ambulant erworbene bakterielle (eitrige) Meningoenzephalitis. Stuttgart: Deutsche Gesellschaft für Neurologie; 2012. Report No.: 313155455X
Google Scholar
-
MSF. Bacterial meningitis. In: Grouzard V, Rigal J, Sutton M, editors. Clinical guidelines diagnosis and treatment manual; 2016. p. 175–9.
Google Scholar
-
Lebech A, Hansen B, Brandt C, von Lüttichau H, Bodilsen J, Wiese L, et al. Rekommandationer for initial behandling af akut bakteriel meningitis hos voksne. Denmark: Dansk Selskab for Infektionsmedicin; 2018.
Google Scholar
-
Artigao F, Lopez R, Castillo Martin del F. Meningitis bacteriana. Spain: Protocolos de la AEP. 3; 2011. p. 47–57.
Google Scholar
-
Khatib U, van de Beek D, Lees JA, Brouwer MC. Adults with suspected central nervous system infection: a prospective study of diagnostic accuracy. J Infect. 2017;74(1):1–9.
Article
Google Scholar
-
McGill F, Griffiths MJ, Bonnett LJ, Geretti AM, Michael BD, Beeching NJ, et al. Incidence, aetiology, and sequelae of viral meningitis in UK adults: a multicentre prospective observational cohort study. Lancet Infect Dis. 2018;18(9):992–1003.
Article
Google Scholar
-
Brouwer MC, van de Beek D. Viral meningitis in the UK: time to speed up. Lancet Infect Dis. 2018;18(9):930–1.
Article
Google Scholar
-
Tunkel A, Hartman B, Kaplan S, Kaufman B, Roos K, Scheld W, et al. Practical guidelines for the management of bacterial meningitis: Infectious Diseases Society of America; 2004 [cited 2017 21 Dec].
-
Shekelle P, Eccles MP, Grimshaw JM, Woolf SH. When should clinical guidelines be updated? BMJ. 2001;323:155–7.
Article
CASGoogle Scholar
-
Shekelle PG, Ortiz E, Rhodes S, Morton SC, Eccles MP, Grimshaw JM, et al. Validity of the Agency for Healthcare Research and Quality Clinical practice Guidelines. JAMA. 2001;286:1461–7.
Article
CASGoogle Scholar
-
European Centre for Disease Prevention and Control. Antimicrobial resistance surveillance in Europe 2015. Stockholm: ECDC; 2017.
Google Scholar
-
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, et al. The global rating scale complements the AGREE II in advancing the quality of practice guidelines. J Clin Epidemiol. 2017;65:526–34.
Article
Google Scholar
Download references
Acknowledgements
Thanks to Belmira Belić and Miranda Hopman at the Julius Center for Health Sciences and Primary Care, European Projects University Medical Center Utrecht, for distributing the electronic survey and to all clinicians who responded to the survey.
Funding
This work forms part of the platform for the European preparedness against (re-)emerging epidemics (PREPARE) Work Package 2. PREPARE is funded by the European Commission’s FP7 Programme grant number 602525. This research was partially funded by the University Of North Carolina School Of Medicine International Health Fellowship Award.
Author information
Author notes
-
Louise Sigfrid and Chelsea Perfect contributed equally to this work.
-
Louise Sigfrid and Chelsea Perfect are joint first authors.
Authors and Affiliations
-
Centre for Tropical Medicine and Global Health, Nuffield Department of Medicine, University of Oxford, Oxford, UK
Louise Sigfrid, Amanda Rojek, James Lee, Gail Carson & Peter Horby
-
University of North Carolina School of Medicine, Chapel Hill, NC, USA
Chelsea Perfect
-
UKERC, Imperial College London, London, UK
Kajsa-Stina Longuere
-
Nuffield Department of Medicine, University of Oxford, Oxford, UK
Sam Lipworth
-
Bodleian Health Care Libraries, University of Oxford, Oxford, UK
Eli Harriss
-
United Kingdom Public Health Rapid Support Team, London, UK
Alex Salam
-
University of Antwerp, Antwerp, Belgium
Herman Goossens
Authors
- Louise Sigfrid
You can also search for this author in
PubMed Google Scholar - Chelsea Perfect
You can also search for this author in
PubMed Google Scholar - Amanda Rojek
You can also search for this author in
PubMed Google Scholar - Kajsa-Stina Longuere
You can also search for this author in
PubMed Google Scholar - Sam Lipworth
You can also search for this author in
PubMed Google Scholar - Eli Harriss
You can also search for this author in
PubMed Google Scholar - James Lee
You can also search for this author in
PubMed Google Scholar - Alex Salam
You can also search for this author in
PubMed Google Scholar - Gail Carson
You can also search for this author in
PubMed Google Scholar - Herman Goossens
You can also search for this author in
PubMed Google Scholar - Peter Horby
You can also search for this author in
PubMed Google Scholar
Contributions
CP, LS, AR and PH designed the project. AR and EH carried out the systematic evidence search. LS, AR and CP screened returned search results. AR, CP, LS and SL independently extracted data from guidelines. The CMGs were critically appraised by CP and LS. KSL, GC, LS and PH distributed the survey. KSL, SL and LS screened the survey results. CP and LS drafted the publication with contributions from SL, JL, EH, HG and PH. All authors reviewed and approved the final content for publication.
Corresponding author
Correspondence to
Louise Sigfrid.
Ethics declarations
Ethics approval and consent to participate
Not applicable.
Consent for publication
Not applicable.
Competing interests
The authors declare that they have no competing interests.
Additional information
Publisher’s Note
Springer Nature remains neutral with regard to jurisdictional claims in published maps and institutional affiliations.
Additional files
Additional file 1:
AGREE II Instrument for the Quality Assessment of Clinical Management Guidelines (PDF 76 kb)
Additional file 2:
Clinical management guidelines included in the review (PDF 57 kb)
Rights and permissions
Open Access This article is distributed under the terms of the Creative Commons Attribution 4.0 International License (http://creativecommons.org/licenses/by/4.0/), which permits unrestricted use, distribution, and reproduction in any medium, provided you give appropriate credit to the original author(s) and the source, provide a link to the Creative Commons license, and indicate if changes were made. The Creative Commons Public Domain Dedication waiver (http://creativecommons.org/publicdomain/zero/1.0/) applies to the data made available in this article, unless otherwise stated.
Reprints and Permissions
About this article
Cite this article
Sigfrid, L., Perfect, C., Rojek, A. et al. A systematic review of clinical guidelines on the management of acute, community-acquired CNS infections.
BMC Med 17, 170 (2019). https://doi.org/10.1186/s12916-019-1387-5
Download citation
-
Received: 21 February 2019
-
Accepted: 09 July 2019
-
Published: 06 September 2019
-
DOI: https://doi.org/10.1186/s12916-019-1387-5
Keywords
- CNS infections
- Meningitis
- Encephalitis
- Meningoencephalitis
- Guidelines
- AGREE II appraisal
Причины
Возбудитель болезни передается от больного человека здоровому воздушно-капельным путем. Бактерии проникают в организм через слизистые полости рта, носа, глотки. При близком контакте с больным возбудитель заболевания при кашле, чихании, поцелуях попадает на слизистую здорового человека и начинает активно размножаться.
В ряде случаев этот процесс не сопровождается никакими симптомами и никак не влияет на общее самочувствие. Такие люди являются бессимптомными носителями инфекции. На сегодняшний день менингококки обнаружены примерно у 15% жителей нашей планеты и это не мешает им оставаться здоровыми людьми.
Но иногда, по не установленным причинам бактерии подавляют иммунную защиту и через слизистую попадают в кровь. Там, используя питательные вещества, они очень быстро размножаются, что приводит к развитию сепсиса и попадают с током крови в мозг или другие внутренние органы (сердце, суставы, легкие и так далее). Продолжительность скрытого периода при поражении мозга (от момента попадания инфекции в организм до появления первых симптомов) составляет 2-10 дней (в среднем 4 суток).
Классификация
Существует несколько классификаций заболевания.
По тяжести течения выделают следующие формы:
- легкая — пациента беспокоят головные боли, наблюдаются симптомы интоксикации организма (тошнота, рвота, общая слабость, вялость), менингеальные симптомы сомнительные;
- среднетяжелая — у больного наблюдается высокая температура (39 градусов Цельсия и выше), появляются менингиальные симптомы, человек находится в сознании;
- тяжелая — у пациента высокая температура, менингеальные симптомы ярко выражены, интоксикация усиливается, нарушается сознание, появляются судороги, возникает отек мозга.
По видам:
- классический — инфекционный процесс наблюдается только в оболочках мозга;
- осложненный — под действием токсинов, выделяемых возбудителем, развиваются системные и локальные осложнения;
- смешанный — клиническая картина дополняется признаками бактериемии и менингоэнцефалита.
В зависимости от продолжительности выделяют следующие формы заболевания:
- острая (продолжается до трех месяцев);
- затяжная (до 6 месяцев);
- хроническая (6 и более месяцев).
В зависимости от локализации очагов поражения различают следующие формы патологии:
- базальная;
- спинальная;
- конвекситальная.
Начинается менингококковая бактериальная форма остро. У пациента резко повышается температура тела, появляются боли в шее, спине, сильные головные боли, возникает непереносимость яркого света и громких звуков.
Наблюдается частая неукротимая рвота, которая не приносит облегчения. Сознание замутненное. Для облегчения самочувствия пациент принимает характерную позу (лежа на боку, ноги подтянуты к животу). Общее состояние здоровья быстро ухудшается.
Довольно быстро (обычно на 2-3 сутки) после появления первых симптомов менингококкового менингита, развиваются менингеальные признаки. Это говорит о том, что произошло поражение оболочек мозга. К таким симптомам относят невозможность разогнуть ногу в колене, ригидность затылочных мышц, когда пациент не может прижать подбородок к груди и ряд других. В ряде случаев на коже пациента появляется сыпь.
Важно! При появлении первых симптомов необходимо немедленно обратиться к врачу для проведения обследования. Чем раньше будет начато лечение, тем лучше прогноз и тем выше шансы на сохранение здоровья и жизни пациента.
Осложнения
Самыми опасными осложнениями заболевания являются:
1. Набухание и отек мозга. Данные осложнения возникают к концу первого-началу второго дня болезни. На фоне бурного течения, с общемозговыми расстройствами, интоксикацией организма, психомоторным возбуждением, пациент теряет сознание. Он перестает реагировать на внешние раздражители Источник:
Скорая медицинская помощь: национальное руководство. Багненко С.Ф., Хубутия М.Ш., Мирошниченко А.Г., Миннуллина И.П. 2018..
Появляются судороги, угасают рефлексы, зрачки сужаются, реакция на свет вялая. Наблюдается снижение ЧСС, которое быстро сменяется тахикардией. Давление вначале снижается, затем, в терминальной стадии, повышается. Дыхание становится шумным, поверхностным, неритмичным, появляется одышка.
Менингеальные симптомы постепенно исчезают, снижается давление спинномозговой жидкости. У пациента наблюдается недержание мочи и кала. Отекают легкие. Летальный исход наступает в результате паралича дыхательного центра и остановки дыхания. Сердце после этого может работать еще несколько минут.
2. Инфекционно-токсический шок. Возникает при бурном течении менингококкемии. Высокая температура спадает до нормальных значений. В первые часы пациенты полностью в сознании. У них наблюдается общее возбуждение, пульс учащенный, плохо прощупывается. Кожа бледная, давление начинает резко падать, наблюдается одышка, цианоз. На фоне почечной недостаточности прекращается выделение мочи. Постепенно возбуждение сменяется состоянием прострации, возникают судороги. Если болезнь не лечить, то через несколько часов или дней неизбежно наступает летальный исход.
При появлении первых подозрительных симптомов необходимо немедленно обратиться к специалисту и пройти обследование. Диагностикой данного заболевания занимаются неврологи и инфекционисты. Если пациент находится в сознании, то врач проводит подробный опрос, выясняя историю болезни. Специалиста интересует, как давно появились симптомы, контактировал ли человек с больными менингитом, имеются ли в анамнезе хронические заболевания, есть ли аллергия на лекарственные средства и так далее.
Далее проводится неврологический осмотр, в ходе которого врач обнаруживает характерные симптомы заболевания. Для подтверждения диагноза и назначения правильного лечения проводятся дополнительные лабораторные и инструментальные исследования Источник:
Клинико-лабораторные особенности менингококковой инфекции, менингитов и менингоэнцефалитов другой этиологии. Фазылов В.Х., Ткачева С.В., Дроздова Н.Ф. Инфекционные болезни: Новости. Мнения. Обучение. 2015. №4. с.68-72.
Самым информативным методом диагностики является пункция спинномозговой жидкости. Врач вводит в спинной мозг, на уровне поясницы, специальную тонкую длинную иглу и берет биоматериал. После этого оценивается внешний вид жидкости, скорость вытекания, физические свойства, биохимический и клеточный состав, характер патологических изменений. Помимо этого, выявляют возбудителя заболевания, что крайне важно для назначения адекватной терапии. Выявить возбудителя также можно путем исследования слизи из носоглотки или крови методом ПЦР.
Помимо пункции пациенту могут быть назначены такие инструментальные методы диагностики, как КТ и МРТ. С их помощью проводят дифференциальную диагностику, выявляют фоновые заболевания мозга, которые влияют на течение менингита.
При помощи нейровизуализации диагностируют такие осложнения, как скопление гноя или спинномозговой жидкости под твердой оболочкой мозга, абсцесс мозга. На поздних стадиях при помощи этой методики определяют очаговые поражения ЦНС, наличие спаек в мозговых оболочках, гидроцефалию.
Лечение
Данное заболевание опасно тем, что часто приводит к развитию тяжелых осложнений и может стать причиной смерти пациента. Поэтому больных немедленно госпитализируют в профильный стационар для оказания неотложной медицинской помощи.
Чаще всего пациентов помещают в отделение неотложной терапии, где они круглосуточно находятся под наблюдением специалистов. Необходимо соблюдать строгий постельный режим.
Лечение медикаментозное и включает в себя назначение следующих групп лекарственных препаратов:
- антибиотики (цефалоспорины, пенициллины) — лечение назначается сразу, не дожидаясь результатов анализов, после определения возбудителя болезни и степени его чувствительности к антибиотикам терапия может быть скорректирована;
- глюкокортикостероиды, мочегонные средства — помогают снять отек мозга;
- коллоидные растворы, переливание очищенной плазмы — для купирования токсикоза;
- антиконвульсанты — для купирования судорог;
- жаропонижающие средства — для нормализации температуры тела;
- анальгетики — для снятия головной боли.
Выписку пациентов проводят только после полного выздоровления. Все больные продолжают находиться под наблюдением специалиста и должны регулярно приходить к нему на прием для проведения профилактического обследования Источник:
Инфекционные болезни. Национальное руководство. Ющук Н.Д., Венгерова Ю.Я. Москва: ГЭОТАР-Медиа. 2019.. Остаточные явления купируют при помощи ЛФК, физиотерапии, когнитивной коррекции.
Если пациент вовремя обратился в клинику и прошел курс лечения, то прогноз благоприятный. В большинстве случаев все заканчивается выздоровлением. Если болезнь запустить, то прогноз неблагоприятный. Примерно 50% пациентов умирает от осложнений.
Если в регионе или конкретном учреждении наблюдаются вспышки заболевания, то медицинские работники должны немедленно провести специальные мероприятия (введение карантина, быстрое выявление и изоляция больных и носителей, соблюдение санитарных норм и так далее).
Лучшей мерой профилактики является вакцинация. В нашей стране прививка от данного вида менингита включена в Календарь профилактических прививок по эпидемическим показаниям. Это значит, что обязательной вакцинации подлежат дети и взрослые, которые находятся в очагах инфекции. Также вакцинируют лиц, которых призывают на военную службу.
Общие рекомендации, которые снижают риск заражения:
- соблюдать правила гигиены;
- отказаться от курения, злоупотребления алкоголем;
- правильно питаться;
- отказаться от любых контактов с заболевшими и скрытыми носителями;
- не переохлаждаться;
- вовремя ложиться спать;
- избегать (по возможности) стрессов и нервного перенапряжения;
- избегать травм головы;
- не купаться в открытых водоемах;
- укреплять иммунитет;
- своевременно лечить сопутствующие заболевания, которые могут привести к поражению мозга.
Менингит
Менингит — воспаление оболочек головного и спинного мозга. Пахименингит — воспаление твердой мозговой оболочки, лептоменингит — воспаление мягкой и паутинной мозговых оболочек. Воспаление мягких оболочек встречается чаще, в таких случаях используют термин «менингит». Его возбудителями могут быть те или иные патогенные микроорганизмы: бактерии, вирусы, грибки; реже встречаются протозойные менингиты. Менингит проявляется сильной головной болью, гиперестезией, рвотой, ригидностью затылочных мышц, типичным положением пациента в постели, геморрагическими высыпаниями на коже. Для подтверждения диагноза менингита и установление его этиологии проводится люмбальная пункция и последующее исследование ликвора.
Общие сведения
Менингит — воспаление оболочек головного и спинного мозга. Пахименингит — воспаление твердой мозговой оболочки, лептоменингит — воспаление мягкой и паутинной мозговых оболочек. Воспаление мягких оболочек встречается чаще, в таких случаях используют термин «менингит». Его возбудителями могут быть те или иные патогенные микроорганизмы: бактерии, вирусы, грибки; реже встречаются протозойные менингиты.
Этиология и патогенез менингита
Менингит может возникать несколькими путями инфицирования. Контактный путь — возникновение менингита происходит в условиях уже существующей гнойной инфекции. Развитию синусогенного менингита способствует гнойная инфекция околоносовых пазух (гайморит), отогенного — сосцевидного отростка или среднего уха (отит), одонтогенного происхождения — патология зубов.Занос инфекционных агентов в мозговые оболочки возможен лимфогенным, гематогенным, чрезплацентарным, периневральным путями, а также в условиях ликвореи при открытой черепно-мозговой травме или позвоночно-спинномозговой травмы, трещине или переломе основания черепа.
Возбудители инфекции, попадая в организм через входные ворота (бронхи, ЖКТ, носоглотка), вызывают воспаление (серозного или гнойного типа) мозговых оболочек и прилегающих тканей мозга. Последующий их отек приводит к нарушению микроциркуляции в сосудах мозга и его оболочках, замедлению резорбции цереброспинальной жидкости и ее гиперсекреции. При этом повышается внутричерепное давление, развивается водянка мозга. Возможно дальнейшее распространение воспалительного процесса на вещество мозга, корешки черепных и спинномозговых нервов.
Классификация менингитов
Менингиты классифицируются по нескольким критериям.
По этиологии:
- бактериальные (пневмококковый, туберкулезный, менингококковый и др.)
- вирусные (вызванный энтеровирусами Коксаки и ЕСНО, острый лимфоцитарый хориоменингит и др.)
- грибковые (криптококкозный, кандидозный и др.)
- протозойные (при малярии, при токсоплазмозе и др.)
По характеру воспалительного процесса:
- гнойный (в ликворе преобладают нейтрофилы)
- серозный (в ликворе преобладают лимфоциты)
По патогенезу:
- первичные (в анамнезе отсутствует общая инфекция или инфекционное заболевание какого-либо органа)
- вторичные (как осложнение инфекционного заболевания)
По распространенности процесса:
- генерализированные
- ограниченные
По темпу течения заболевания:
- молниеносные
- острые
- подострые
- хронические
По степени тяжести:
- легкой формы
- средней тяжести
- тяжелой формы
- крайне тяжелой формы
Клиническая картина менингита
Симптомокомплекс любой формы менингита включает в себя общеинфекционные симптомы (жар, озноб, повышение температуры тела), учащение дыхания и нарушение его ритма, изменение ЧСС (в начале заболевания тахикардия, по мере прогрессирования заболевания — брадикардия).
В состав менингеального синдрома входят общемозговые симптомы, проявляющиеся тоническим напряжением мышц туловища и конечностей. Нередко появляются продормальные симптомы (насморк, боли в животе и др.). Рвота при менингите не связана с приемом пищи, а появляется сразу после смены положения или при усилении головной боли. Головные боли, как правило, распирающего характера очень мучительны для пациента, могут локализоваться в затылочной области и отдавать в шейный отдел позвоночника. Кроме того, пациенты болезненно реагируют на малейший шум, прикосновения, свет, поэтому стараются избегать разговоров и лежат с закрытыми глазами. В детском возрасте возможно появление судорог.
Для менингита характерна гиперестезия кожи и болезненность черепа при перкуссии. В начале заболевания отмечается повышение сухожильных рефлексов, но с развитием заболевания они снижаются и нередко исчезают. В случае вовлечения в воспалительный процесс вещества мозга развиваются параличи, патологические рефлексы и парезы. Тяжелое течение менингита обычно сопровождается расширением зрачков, диплопией, косоглазием, нарушение контроля над тазовыми органами (в случае развития психических расстройств).
Симптомы менингита в старческом возрасте атипичны: слабое проявление головных болей или полное их отсутствие, тремор головы и конечностей, сонливость, психические расстройства (апатия или, наоборот, психомоторное возбуждение).
Диагноз и диффдиагноз
Основным методом диагностирования (или исключения) менингита является люмбальная пункция с последующим исследованием цереброспинальной жидкости. В пользу данного метода говорят его безопасность и простота, поэтому проведение люмбальной пункции показано во всех случаях подозрения на менингит. Для всех форм менингита характерно вытекание жидкости под высоким давлением (иногда струей). При серозном менингите цереброспинальная жидкость прозрачная (иногда слегка опалесцирующая), при гнойном менингите — мутная, желто-зеленого цвета. С помощью лабораторных исследований цереброспинальной жидкости определяют плеоцитоз (нейтрофилы при гнойных менингитах, лимфоциты при серозных менингитах), изменение соотношения количества клеток и повышенное содержание белка.
В целях выяснения этиологических факторов заболевания рекомендовано определение уровня глюкозы в цереброспинальной жидкости. В случае туберкулезного менингита, а также менингита, вызванного грибами, уровень глюкозы снижается. Для гнойных менингитов типично значительное (до нуля) снижение уровню глюкоза.
Главные ориентиры невролога в дифференциации менингитов — исследование цереброспинальной жидкости, а именно определение соотношения клеток, уровня сахара и белка.
Лечение менингита
В случае подозрения на менингит госпитализация пациента обязательна. При тяжелом течении догоспитального этапа (угнетение сознания, лихорадка) пациенту вводят преднизолон и бензилпенициллин. Проведение люмбальной пункции на догоспитальном этапе противопоказано.
Основа лечения гнойного менингита — раннее назначение сульфаниламидов (этазол, норсульфазол) или антибиотиков (пенициллина). Допускает введение бензилпенициллина интралюмбально (в крайне тяжелом случае). Если подобное лечение менингита в течение первых 3 дней оказывается неэффективным, следует продолжить терапию полусинтетическими антибиотиками (ампициллин+оксациллин, карбенициллин) в сочетании с мономицином, гентамицином, нитрофуранами. Доказана эффективность такого сочетания антибиотиков до выделения патогенного организма и выявления его чувствительности к антибиотикам. Максимальный срок такой комбинационной терапии — 2 недели, после чего необходимо перейти на монотерапию. Критериями для отмены также служат снижение температуры тела, нормализация цитоза (до 100 клеток), регресс общемозговых и менингеальных симптомов.
Основу комплексного лечения туберкулезного менингита состоит в непрерывном введении бактериостатических доз двух-трех антибиотиков (например, изониазид+стрептомицин). При появлении возможных побочных эффектов (вестибулярные расстройства, нарушение слуха, тошнота) отмена данного лечения не требуется, показано уменьшение дозы антибиотиков и временное добавление к лечению десенсибилизирующих препаратов (дифенгидрамин, прометазин), а также других противотуберкулезных препаратов (рифампицин, ПАСК, фтивазид). Показания к выписке пациента: отсутствие симптомов туберкулезного менингита, санация цереброспинальной жидкости (спустя 6 месяцев от начала заболевания) и улучшение общего состояние пациента.
Лечение вирусного менингита может ограничиться применением симптоматических и общеукрепляющих средств (глюкоза, метамизол натрия, витамины, метилурацил). В тяжелых случаях (выраженные общемозговые симптомы) назначают кортикостероиды и диуретики, реже — повторную спинномозговую пункцию. В случае наслоения бактериальной инфекции возможно назначение антибиотиков.
Прогноз
В дальнейшем прогнозе важную роль играют форма менингита, своевременность и адекватность лечебных мероприятий. В качестве резидуальных симптомов после туберкулезного и гнойного менингита зачастую остаются головные боли, внутричерепная гипертензия, эпилептические припадки, нарушения зрения и слуха. По причине запоздалого диагностирования и устойчивости возбудителя к антибиотикам высок уровень смертности от гнойных менингитов (менингококковая инфекция).
Профилактика
В качестве профилактических мер по предупреждению менингита предусматривается регулярное закаливание (водные процедуры, спорт), своевременная терапия хронических и острых инфекционных заболеваний, а также короткие курсы иммуностимулирующими препаратами (элеутерококк, женьшень) в очагах менингококкового менингита (детский сад, школа и др.).